ســــــــــــــــــــــــــــــــــــــــــــــــــــلامی
به گــــــــــــرمی نـــــــــــــفسهاتون..
محسن
فوق لیسانس مدیکال مایکولوژی
و ســـــــــــــاکن شهر تهـــــــــــــــــران
هـــــــــــــــــــــــــــــــــــــــــــــستم.
امیــــــــــــــــــــــــــــــــــــدوارم که
لحظـــــــــــــــــات خـــــــــوب و خوشی
را در وبـــــــلاگم سپـــــــــــــــری نمایید.
.
.
1388 دانشگاه علوم پزشکی قم - کارشناسی
1393 دانشگاه علوم پزشکی اصفهان - کارشناسی ارشد
........(_\.........
.../_)...) \........
../ (....(__)......
.(__)...oooO....
Oooo..............
.
گفتم غم تو دارم گفتا غمت سر آید گفتم که ماه من شو گفتا اگر برآید
گفتم ز مهرورزان رسم وفا بیاموز گفتا ز خوب رویان این کار کمتر آید
گفتم که بر خیالت راه نظر ببندم گفتا که شبرو است او، از راه دیگر آید
گفتم که بوی زلفت گمراه عالمم کرد گفتا اگر بدانی هم اوت رهبر آید
گفتم خوشا هوایی کز باد صبح خیزد گفتا خنک نسیمی کز کوی دلبر آید
گفتم که نوش لعلت ما را به آرزو کشت گفتا تو بندگی کن کو بنده پرور آید
گفتم دل رحیمت کی عزم صلح دارد گفتا مگوی با کس تا وقت آن درآید
گفتم زمان عشرت دیدی که چون سر آمد گفتا خموش حافظ کاین غصه هم سر آید
آزمایش پی تی (PT) یکی از چندین آزمایشي است که بررسی میکند آیا خون شما به طور طبیعی لخته میشود یا خیر. برای جلوگیری از خونریزی به لخته شدن خون (انعقاد) نیاز است. پروتئینهای موجود در خون به نام فاکتورهای لخته کننده به چسبندگی خون کمک میکنند. آنها خون را از مایع به جامد تغییر شکل میدهند.
وقتي خونی را در قسمتی از بدن خود مشاهده کردید يا قسمتي از بدن شما شروع به خونریزی كرد، سلولهای پلاکت خون در اطراف ناحیه خونریزی جمع میشوند. سپس سلولهای پلاکت و فاکتورهای لخته كننده واکنش نشان میدهند تا خون غلیظ شده و خونریزی متوقف شود. مشکلات موجود در خون از جمله کم بودن میزان فاکتورهای لخته كننده یا پلاکت میتواند از لخته شدن طبیعی خون جلوگیری کرده و باعث خونریزی بیش از حد شود.
عوامل لخته كننده معمولاً توسط کبد ساخته میشوند. پروترومبین یکی از انواع فاکتورهای لخته كننده است. وقتی خونریزی در بدن اتفاق میافتد، پروترومبین به سرعت به ترومبین تبدیل میشود. آزمایش پی تی میزان تغییر سریع پروترومبین به ترومبین را برای متوقف کردن خونریزی اندازه گیری میکند. اگر پروترومبین به سرعت تغییر نكرد ممكن است مبتلا به اختلال لخته شدن خون باشید.
آزمایش پیتی PT و INR برای چیست؟
این آزمایش ممکن است برای کمک به تشخیص اختلالات ارثی و سایر مشکلات و بیماریهایی انجام شود که ممکن است روی لخته شدن خون تأثیر بگذارد. این مشکلات شامل موارد زیر است:
- کمبود ویتامین K
- کمبود فاکتور I ،II ،V ،VII یا X در لخته شدن
- بیماریهای کبد
- هموفیلی
- مشکلات مغز استخوان
- بیماری فون ویلبراند
- مشکلات سیستم ایمنی بدن
- برخی از انواع سرطانها از جمله سرطان خون
در صورت مشاهده علائم اختلال خونریزی ممکن است به این آزمایش نیاز داشته باشید. این علائم میتواند شامل موارد زیر باشد:
- دورههای قاعدگی غیرطبیعی در زنان
- خونریزی مکرر از بینی
- خونریزی راحتتر
- کبودی راحتتر
- خونریزی زیاد
- خون در مدفوع
اگر داروی رقیق کننده خون مانند وارفارین مصرف میکنید، ممکن است به طور مرتب به انجام اين آزمایش برای اطمینان از دوز مناسب آن نیاز داشته باشید.
ممکن است قبل از جراحی یا عمل به این آزمایش به منظور کمک به اطمینان از لخته شدن خون به طور معمول نياز داشته باشيد تا پس از جراحی با خونریزی مشکلی نداشته باشید.
چگونه میتوانم برای آزمایش پی تی PT و INR آماده شوم؟
معمولاً نیازی به آمادگی خاصی برای این آزمايش ندارید. در صورت نیاز پزشک به شما میگوید که چند ساعت قبل از آزمایش ناشتا باشید. و همچنين پزشک ممکن است از شما بخواهد مصرف هر دارویی که ممکن است بر نتایج آزمایش شما تأثیر بگذارد، به ویژه داروهایی که از لخته شدن خون جلوگیری میکنند، متوقف کنید. مطمئن شوید که پزشک شما از همه داروها، گیاهان، ویتامینها و مکملهایی که مصرف میکنید اطلاع دارد. حتی داروهایی که نیازی به نسخه ندارند و سایر داروهای غیرقانونی که ممکن است استفاده کنید.
آزمایش پی تی PT و INR

آزمایش پیتی PT و INR در دمای 37 درجه سانتی گراد انجام میشود. این آزمايش را میتوان به صورت دستی یا خودکار انجام داد.
- خون وریدی به داخل یک لوله آزمایش کشیده میشود که حاوی سدیم مایع (غلظت 3.2٪) به عنوان ضد انعقاد است. از نمونه مویرگی یا سر انگشت نیز ممکن است استفاده شود. اگر بیمار تحت مصرف وارفارین یا سایر داروهای ضد انعقاد باشد، نمونه خون باید قبل از مصرف دوز روزانه جمعآوری شود.
- نمونه خون پس از مخلوط کردن، سانتریفیوژ میشود تا پلاسما از سلولهای خون جدا شود.
- نمونهای از این پلاسما در لوله آزمایش گرفته میشود.
- سپس مقدار اضافی کلسیم (در یک سوسپانسیون فسفولیپید) به لوله آزمایش اضافه میشود. این کار اثرات سیترات را برعکس کرده و باعث لخته شدن پلاسما میشود.
- سرانجام ترومبوپلاستین یا فاکتور بافتی فاکتور III به لوله آزمایش اضافه میشود تا روند لخته شدن فاکتور خارجی / بافتی فعال شود.
- زمان نمونه گیری برای لخته شدن یا به صورت دستی با استفاده از ساعت متوقف میشود یا به صورت نوری با استفاده از یک ابزار خودکار اندازه گیری میشود.
چه تستهای دیگری ممکن است همراه با این آزمايش داشته باشم؟
علاوه بر آزمایش پی تی PT و INR، ممکن است به آزمایشات دیگری نیاز داشته باشید که توانایی لخته شدن طبیعی خون را اندازه گیری کند. این آزمایشها ممکن است شامل موارد زیر باشد:
- تست زمان ترومبین (TT)
- زمان ترومبوپلاستین جزئی فعال (aPTT)
- آزمایشات دیگری که جنبههای لخته شدن خون را اندازهگیری میکنند، مانند عمل پلاکت
نتایج آزمایش من به چه معناست؟
نتایج آزمایش PT ممکن است بسته به سن، جنسيت، سابقه سلامتی، روش استفاده شده برای آزمایش و سایر موارد متفاوت باشد. نتایج آزمایش شما ممکن است به معنای مشکل شما نباشد. از پزشک خود بپرسید که نتایج آزمایش شما برای شما چه معنی دارد.
این نتیجه آزمایش اغلب در عرض چند ثانیه گزارش میشود. زمان لخته شدن معمولاً بین 11 تا 13 ثانیه است. اگر خون شما در آن بازه زمانی نرمال لخته نشود، ممکن است اختلال لخته شدن یا خونریزی داشته باشید.
اگر آزمایش پی تی PT دارید و داروی ضد انعقادی مانند وارفارین مصرف میکنید، نتیجه اغلب به عنوان عددی گزارش میشود که نتیجه شما را با مقدار استاندارد مقایسه میکند. این نسبت بین المللی نرمال (INR) نامیده میشود. پزشکان معمولاً انتظار دارند INR در افرادی که داروی رقیق کننده خون مانند وارفارین مصرف ميكنند، بین 2.0 تا 3.0 باشد.
آیا آزمایش پی تی PT و INR خطری دارد؟

انجام آزمایش خون با سوزن خطرات زیادی را به همراه دارد. این موارد شامل خونریزی، عفونت، کبودی و احساس سبکی سر است. هنگامی که با سوزن از بازو یا دست شما خون گرفته میشود، ممکن است کمی احساس سوزش یا درد کنید.
چه چیزی ممکن است بر نتایج آزمايش من تأثیر بگذارد؟
تعدادی از داروها میتوانند نتایج آزمایش را تحت تأثیر قرار دهند. این داروها شامل مواردی هستند که برای جلوگیری از لخته شدن خون استفاده میشوند، مانند:
- وارفارین
- آسپرین
- سایر داروهای رقیق کننده خون مانند مهار کنندههای مستقیم ترومبین و مهار کنندههای فاکتور Xa
- هپارین
سایر داروهایی که ممکن است بر نتایج تأثیر بگذارند عبارتند از:
- برخی از استروئیدها
- آنتی بیوتیکها
- داروهای استروژن
- آنتی اسیدها
اگر نمونه خون شما به درستی جمع نشده باشد، ممکن است نتایج آزمایش شما نیز تحت تأثیر قرار گیرد.
موضوعات مرتبط: هماتولوژي

سرطان روده بزرگ
یکی ازشایعترین سرطان هایی که مردم ایران به آن مبتلا میشوند سرطان روده ی بزرگ است .
این بیماری از پولییپ های روده منشا میگیرند ، در واقع پولیپ رشد غیرطبیعی تودههای خوشخیم در جدار اعضای بدن است که پس از گذشت مدت زمانی طولانی تبدیل به سرطان میشود و علائم خود را نشان میدهد.
ابتلا به سرطان روده بزرگ یا راست روده برای افراد بالای ۵۰ سال معمول تر است چنانچه در اقوام یا یکی از نزدیکان خانوادگی خود فردی رامیشناسید که به این بیماری مبتلا است و یا تعداد این افراد از دو یا سه بیشتر است احتمال ابتلای سایر بستگان نیز وجود دارد .
ممکن است سرطان در سنین پایین تر از ۵۰ سال نیز اتفاق بیافتد ، در اغلب موارد که آماری نزدیک به ۵ تا ۱۰ درصد است ابتلا به سرطان روده بزرگ به دلیل نقایص ژنتیکی نیز دیده میشود که منجر به بروز این اتفاق در در افرادی با سنین پایین تر میشود.
درمان-سرطان-روده-بزرگ
علائم این بیماری چیست؟
اولین و مهمترین علامت برای این سرطان دفع خون روشن از روده بزرگ است .
با مشاهده خون روشن در مدفوع و یا دفع مشکوک و بی اندازه ی خون به این سرطان مشکوک شوید. البته ممکن است هر فرد در طول عمر به دلیل بواسیر یا مشکلات مقعدی شاهد دفع خون دراین ناحیه باشد که جای نگرانی نیست.
این حالت نباید نگرانی ایجاد کند؛ منظور از دفع خون، خونی است که اخیرا شروع شده و چند بار تکرار میشود و این زنگ خطری است که بیمار با مراجعه به پزشک شکایت خود را مطرح کند تا اقدامات درمانی آغاز شود.
کاهش وزن ناگهانی و بی اراده نیز از علائم این سرطان است .
اگر دچار کاهش وزن و کم خونی شدید در یک مدت کوتاه شده اید ممکن است که مشکلات گوارشی داشته باشید . با انجام آزمایش میتوانید این مشکل را بررسی نمایید .
تشخیص سرطان با انجام آزمایش
سرطان روده ممکن است سالها به طول بینجامد و تشخیص به موقع آن، شانس بهبودی را بهطور چشمگیری افزایش میدهد.
چنانچه به این بیماری مشکوک هستید و سوابق خانوادگی شما احتمال ابتلا ی شمارا نیز افزایش میدهد با پیشگیری و درمان به موقع از مشکلات ناشی از این سرطان جلوگیری نمایید .
در ضمن به افرادی که علائم سرطان روده بزرگ را دارند توصیه میشود آزمایش های زیر را انجام دهند
آزمایش دیجیتال کولون (DRE)
آزمایش وجود لخته خون در مدفوع
آزمایش خون
پروکتوسکوپی: با استفاده از دستگاه های خاص داخل روده مشاهده میشود. در اکثر مواقع بیشتر بیماریهای روده با این روش شناسای میشود و بیمار احساس درد نمیکند.
کولونوسکوپی
بیوپسی:بررسی قسمتی ازروده با تلسکوپ ، که در این روش قسمتی از روده را برید و بیماری آن را شناسایی میکنند.
مشاوره ژنتیک
موضوعات مرتبط: هماتولوژي
پژوهشگران دانشگاه علوم پزشکي تهران با همکاري دانشگاه رازي کرمانشاه موفق به طراحي نانوموتوري شدند که قادر است سلولهاي سرطان خون (لوسمي) را از نمونهي خون مورد آزمايش جدا کند. ساخت اين نانوموتور به منظور جداسازي و در ادامه اندازهگيري ميزان غلظت سلولهاي سرطاني در نمونهي خون فرد مبتلا، توسط يک نانوحسگر زيستي انجام شدهاست.
به گزارش ستاد ويژه توسعه فناوري نانو،در سال 2016، نزديک به 25 هزار نفر در سراسر دنيا، جان خود را بر اثر بيماري سرطان خون از دست دادند. از طرفي، براساس آمار سازمان بهداشت جهاني(NIH)، هزينهي اوليهي درمان بيماران لوسمي براي هر نفر حدود 36000 دلار برآورد شدهاست. جداسازي و اندازهگيري گونههاي بيولوژيکي، از جمله سلولهاي سرطاني از نمونههاي انساني به کمک روشهايي نظير فلورسانس، از پرهزينهترين مراحل تشخيص و درمان بيماري است. با توجه به هزينهي بالاي اين فرايند، ارائهي روشي جايگزين به منظور کاهش هزينهي مراحل درماني ضروري به نظر ميرسد. زيستحسگرهاي الکتروشيمايي برپايهي گيرندههاي زيستي (bio-receptor) همچون آنتي باديها و آپتامرها، به دليل حساسيت بالا، قيمت مناسب و سهولت کار، يکي از بهترين گزينهها جهت اندازهگيري سلول سرطاني است.
دکتر محمود عموزاده تبريزي، عضو هيأت علمي پژوهشگاه علوم نوين در پزشکي، در خصوص اهداف دنبال شده در اين طرح عنوان کرد: «اين کار پژوهشي شامل دو بخش اصلي است. در بخش اول تلاش شده تا با بهکارگيري موادي ارزان قيمت، نانوموتوري ساخته شود که بتوان از آن بهمنظور جداسازي سلول سرطان HL-60 استفاده کرد. در ادامه نيز با طراحي يک نانوحسگر زيستي به اندازهگيري غلظت اين سلول سرطاني پرداخته شدهاست. البته در ساخت هر دوي آنها از آپتامر نيز بهره گرفته شدهاست.» نتايج اين پژوهش در حوزهي پزشکي و زمينهي ساخت ابزارهاي تشخيص طبي جهت اندازهگيري سلولهاي سرطاني کاربردي خواهند بود.
به گفتهي اين محقق نانوموتور بهکار رفته در جداسازي سلول سرطاني در اين پژوهش، نسبت به موارد گزارش در ساير منابع علمي ارزانتر است. از طرفي با توجه به اين که در ساخت آن از آپتامر استفاده شدهاست، اين نانوموتور از گزينش پذيري خوبي براي جداسازي سلول سرطاني برخوردار است. همچنين کاربرد آپتامر در ساخت نانوحسگر نيز منجر به گزينشپذيري بالاي آن شدهاست.
موضوعات مرتبط: هماتولوژي
نوتروفیلها , لنفوسیت ها , مونوسیت ها , ائوزینوفیل ها و بازوفیلها.
در اثر شیمی درمانی , تعداد گلبولهای سفید کاهش پیدا می کند. کاهش گلبولهای سفید بدن را مستعد عفونت می نماید.
در بیماران سرطانی کاهش گلبول سفید و عفونت یکی از جدی ترین و مهمترین عارضه های درمان محسوب می شود. , که نیازمند دقت و توجه زیادی از طرف پزشک معالج , کادر درمان و بیمار می باشد.
علایم افت گلبول سفید چیست؟
بهترین روش شناسایی افت گلبول سفید , آزمایش CBC است . معمولاً این آزمایش توسط پزشک معالج طی دوره های منظمی انجام می شود. در اغلب مواقع با افت گلبول سفید , عوامل بیماریزا فرصت پیدا می کنند تا در بدن رشد نمایند و عفونت از درجات خفیف تا شدید در بیمار ظاهر می شود.
علایم افت گلبول سفید هم بیشتر همان علایم عفونت هستند :
تب و لرز ، سردرد ، سرفه ، عطسه، آبریزش بینی ، خارش گلو ، قرمزی پوست ، بی حالی ، سوزش ادرار ، اسهال ، زخم دهان ، درد عضلانی ،کم اشتهایی .
نوتروپنی چیست؟
همانطوریکه در سطور بالا گفته شده , گلبول سفید انواع مختلفی دارد.
در بین طیفهای مختلف گلبول سفید نوتروفیلها جهت مبارزه با میکروبهای بیماریزا نقش مهمتری بر عهده دارند. نوتروفیلها تحت علامت اختصاری Neut یا Neutrophil در آزمایش خون مشخص می شوند. گاهی هم در برخی آزمایشگاهها تحت عنوان Poly نامیده می شوند.
معمولاً در آزمایشات خون تعداد نوتروفیلها به درصد مشخص می شود. در حالت طبیعی ۵۰ تا ۷۰ در صد از گلبولهای سفید نوتروفیل هستند. در بیماران سرطانی این در صد کاهش پیدا می کند. نوتروپنی یعنی کاهش تعداد نوتروفیلهای خون.
ممکن است یک بیمار تعداد کل گلبولهای سفیدش یعنی WBC طبیعی باشد اما تعداد نوتروفیلهایش کم باشد. این حالت یعنی اینکه با وجود طبیعی بودن تعداد گلبولهای سفید ، به دلیل کم بودن نوتروفیلها بدن قادر به مبارزه با میکروبها نیست و مورد تهاجم آنها قرار گرفته یا احتمال حمله بسیار زیاد است.
تعداد نوتروفیلها معیار مناسبی جهت پیش بینی احتمال بروز عفونت در بیمار محسوب می شود.
نوتروفیل زیر ۱۰۰۰: اگر تعداد نوتروفیل مطلق بیماری زیر ۱۰۰۰ باشد ، سیستم ایمنی وی جهت مبارزه با میکروبها کافی نیست و می تواند دچار عفونت شود.
نوتوفیل زیر ۵۰۰: اگر برای چند روز مداوم تعداد نوتروفیل مطلق زیر ۵۰۰ باشد ، احتمال ابتلا به عفونت بالاست.
نوتروفیل زیر ۱۰۰: اگر برای بیش از یک هفته تعداد نوتروفیلها زیر ۱۰۰ باشد ، احتمال ابتلاء به عفونت بسیار بالاست.
پزشک معالج جهت جبران افت گلبول سفید چه اقداماتی انجام می دهد؟
پزشک معالج با توجه به جواب آزمایش CBC , وضعیت گلبول سفید را بررسی می کند. سپس بیمار را از نظر وجود یا عدم وجود عفونت معاینه می نماید . در صورت عفونت آنتی بیوتیک مناسب را تجویز می کند , همچنین در صورت لزوم جهت افزایش میزان گلبول سفید از داروی فاکتور رشد گلبول سفید (G_CSF) استفاده می کند.
در صورت افت گلبول سفید چه اقدامی انجام دهم؟
اول اینکه نگران نباشید , افت گلبولهای سفید نشانه وخامت بیماری در شما نیست. این اتفاق در اغلب بیماران تحت شیمی درمانی رخ می دهد و قابل کنترل است.
دوم اینکه , شما می توانید در کنار پزشکتان نقش بسیار حائز اهمیتی در کنترل این عارضه داشته باشید.
اقدامات شما در دو بخش طبقه بندی شده است:
الف: اقدامات قبل از عفونت.
ب: اقدامات بعد از عفونت.
اقدامات قبل از عفونت
اکثر بیماران تحت شیمی درمانی , درجاتی از کاهش گلبول سفید را تجربه می کنند. بنابراین مستعد ابتلا به عفونت هستند. با انجام اقدامات قبل از عفونت می توانید تا حدود زیادی از این عارضه جلوگیری نمائید. برخی از این اقدامات عبارتند از :
۱- شستن مرتب دستها به روش علمی : مهمترین ، آسانترین و موثر ترین راه پیشگیری از انتقال میکروبها شستشوی صحیح و مرتب دستان است. با وجودیکه همه ما روزانه بارها این کار را انجام می دهیم ، اما متاسفانه بسیاری از ما به روش صحیح و علمی این کار را انجام نمی دهیم.دستهای یکی از مهمترین راههای انتقال عفونت هستند.
در چه مواقعی باید دستها به روش علمی شستشو شود؟
بعد از دست دادن با دیگران
قبل و بعد از طبخ و آماده سازی غذا
قبل و بعد از تعویض لباس یا پوشک کودک
و به طور کلی قبل و بعد از تماس با بیمار
چه کسانی باید دستانشان را به روش علمی و اصولی شستشو کنند؟
همه کسانی که با بیمار در تماس هستند باید طبق اصول علمی و صحیح این کار را انجام دهند.
آیا برای شستشو باید از مواد ضد عفونی کننده استفاده کنم؟
خیر ؛ در حالتی که بیمار سالم است و دچار عفونت نشده ، آب ولرم و صابون کفایت می کند.
روش صحیح شستشو چگونه است؟
در اینجا روش صحیح به کمک عکس مشروح می گردد.
مدت زمان شستشو چقدر است؟
مدت زمان شستشو باید بین ۲۰ تا ۳۰ ثانیه باشد ، تا عوامل بیماریزا به درستی از روی پوست پاک شود. قبل از شستشو باید ساعت ، حلقه و انگشتر از دست خارج شود.
آیا پوشیدن دستکش یکبار مصرف می تواند جایگزین شستشوی مرتب باشد؟
خیر ؛ استفاده از دستکش جهت نظافت بیمار اشکالی ندارد ، اما جایگزین شستشوی دست نیست و شستشوی دست ، قبل و بعد از استفاده از دستکش الزامی است.
بهترین وسیله خشک کردن دستها بعد از شستشو چیست؟
بهترین وسیله دستمال کاغذی یکبار مصرف است.
آیا انجام چنین روشی برای شستشوی دست کودک سرطانی هم ضروری است؟
خیر ؛ اما لازم است بعد از بازی با اسباب بازی و قبل از خوردن غذا به صورت معمول دستانش را شستشو کنید.
۲- استحمام و تعویض لباس روزانه مراقب :
بیمار سرطانی باید به طور روزانه استحمام و تعویض لباس را انجام دهد . گاهی به دلیل خستگی بیمار قادر به استحمام روزانه نیست , در چنین مواقعی همان تعویض روزانه لباس کفایت می کند.
نوزادان و کودکان سرطانی زیر دو سال در تماس نزدیک و دائم با مادر خود قرار دارند و استحمام و تعویض لباس روازنه مادر هم در این گروه از بیماران الزامی است.
لباس و ملحفه کودک سرطانی باید به صورت روزانه تعویض شود . اما استحمام روزانه لازم نیست و می تواند با توجه به قوای بدنی ، یکروز در میان یا دو روز درمیان انجام شود ، اما فاصله بیش از دو روز برای استحمام صحیح نیست و حتی اگر کودک ضعف عمومی دارد باید این کار به صورت حمام روی تخت انجام پذیرد (در خصوص حمام روی تخت از یک کمک بهیار متبحر کمک بگیرید). در حین تعویض لباس می توانید پوست جاهای مختلف بدنش را از نظر قرمزی و زخم بررسی نمائید.
نکته اینکه استفاده از آب بسیار داغ در بیمار سرطانی ممنوع است چون علاوه بر خطر سوختگی ، ممکن است صدمات ریزی در پوست ایجاد کند که از طریق آن میکروبها به بدن نفوذ نمایند.
۳- واکسیناسیون:
در کل دوره درمان انجام هر گونه واکسیناسیون بدون مشورت با پزشک معالج ممنوع است.در کودکان سرطانی که به مدرسه می روند این مسئله را به اطلاع معلم و مدیر مدرسه وی برسانید.
همچنین کودک سرطانی باید از کودکانی که به تازگی واکسیناسیون انجام داده اند ، دور باشند.
۴- اماکن شلوغ:
در اماکن شلوغ شانس ابتلا به عفونتهای ویروسی افزایش پیدا می کند ، حدالمقدور باید از بردن بیمار به مکانهای شلوغ مانند : مترو ، اتوبوس ،میهمانی های شلوغ ، مراکز خرید و غیره خودداری کرد. اما اگر به هر دلیلی بیمار مجبور شد به چنین مکانهایی برود باید از ماسک N95 استفاده کند و مدت زمان توقت تا حد ممکن کوتاه باشد.
۵- اماکن زیارتی:
در بیماران بزرگسال زیارت قبور متبرکه بدلیل ایجاد آرامش قلبی و کاهش اضطراب می تواند موثر و مفید باشد. توسل به ائمه و اولیای خدا همواره یکی از ارزشمند ترین عوامل کمک کننده به فرد در مصائب و مشکلات محسوب می شود. اما چنین زیارتهایی حتماً باید با اطلاع و اجازه پزشک معالج صورت پذیرد .
این اقدام درکودکان سرطانی به دلیل ضعیف تر بودن و خطر ابتلاء به عفونت خطرناک است. بنابراین اگر به دلیل باورهای دینی نذر یا توسلی انجام می دهید ، بردن کودک را به مکان مذکور شرط قرار ندهید و تنها به حضور خود و ادای مراسم اکتفا کنید ، و حتماً بعد از زیارت استحمام کرده لباس خود را تعویض کنید.
مسئله دیگری که غالباً در فرهنگ ما متداول است ، استفاده از پارچه های سبز به صورت دستبند متبرک است. این دستبند ها می تواند محل تجمع قارچها و میکروبها باشد و استفاده از آنها در کودکان سرطانی خالی از اشکال نیست. شما می توانید چنین دستبندهایی را در جا نماز خود گذارده و هنگام عبادت کنار مهر خود بگذارید.
۶ – تماس با سایرین و ملاقاتها:
عاطفه و محبت ایرانی همواره زبانزد است . عیادت از بیمار در دین و آئین ما ایرانی ها بسیار مورد توجه قرار دارد. بزرگانی چون سعدی در خصوص آداب عیادت توصیه هایی دارند که مطالعه آن خالی از لطف نیست. ما هم با سعدی در این زمینه هم عقیده هستیم. چون چه بسا یک سرماخوردگی خفیف فرد ملاقاتی ، که حتی خودش هم از آن اطلاع ندارد ، جان کودک را به مخاطره بیاندازد. از صندلی که در اتوموبیل بر آن نشسته اند تا دستان و لباسهایشان و حتی زیور آلات و هوای بازدمشان می تواند مملو از میکروب باشد.
اینجا جایی است که باید خجالت و رودربایستی را کنار بگذارید , قطعاً همه دوستداران بیمار با قبول این شرایط می توانند نقش بسیار حائز اهمیتی در روند درمان بیمار بازی کنند و با رعایت اصول زیر عضوی از تیم درمان بیمار باشند.
نکته اول اینکه بطور کلی ، ملاقات بیمار در بیمارستان ممنوع است. تحت هیچ شرایطی نباید این کار صورت پذیرد ، این مسئله ارتباط مستقیم با سلامت وی دارد. ملاقاتها باید تنها در منزل و آنهم تحت شرایطی که در زیر توضیح داده شده است انجام شود.
ملاقاتهای در منزل باید بسیار محدود و کم جمعیت باشد.
از همه اقوام و بستگانتان بخواهید ، به جای ملاقات به تماس تلفنی اکتفا کنند.
متقاعد کردن برخی اقوام نزدیک بسیار دشوار است. به خصوص اگر بیمار کودک باشد. عکسی از کودک دلبندتان بگیرید و چاپ نمائید و از آنها خواهش کنید در لحظات دلتنگی عکس را در آغوش بگیرند و هرگز با لباس بیرون وی را در آغوش نفشارند. این روزها می توان عکس را بر روی بالش و سایر وسایل آغوش گرفتنی به راحتی چاپ کرد.
در کودک سرطانی این مسئله در مورد پدرها هم که غالباً ساعاتی از روزدر بیرون از منزل هستند , صدق میکند ، وی باید در بدو ورود به منزل استحمام نموده ، لباس تمیزی بر تن کند و سپس کودک را در آغوش بگیرد.
در مورد کودک سرطانی در منزل قانونی وضع کنید که هرگز هیچ فردی بدون رعایت نکات زیر به بیمار نزدیک نشود:
ابتدا از صحت و سلامت جسمی کامل خود اطمینان داشته باشد و دچار بیماری مسری حتی یک سرماخوردگی خفیف هم نباشد.
لباس بیرون را از تن خارج کرده و استحمام نماید.
لباس تمیزی بر تن کند.
سپس کودک را برای دقایقی در آغوش بگیرد ، و هر چه زودتر اتاق را ترک نماید.
در زمان آغوش گرفتن از دستمالی صورت ، بینی و چشمان کودک خودداری نماید.
گاهی مشاهده میشود که ملاقاتی ها از تخت بیمار برای نشستن استفاده می کنند ، این اشتباه روی اشتباه است ، چون هم ملاقات در بیمارستان ممنوع و مضر است هم نشتسن بر روی تخت.
۷- از پوست و مخاط دهان بیمار مراقبت کنید:
پوست و پوشش داخلی دستگاه گوارش (مخاط) اولین سد دفاعی بدن محسوب می شود. بسیاری از باکتری های فرصت طلب در حالت عادی بر روی پوست وجود دارند و بیماریزا نیستند اما وقتی میزان گلبولهای سفید کاهش پیدا می کند ، می توانند موجب بیماری شوند. انجام شیمی درمانی و اشعه درمانی پوست را شکننده و خشک می نماید که همین مسئله می تواند نفوذ باکتریها به داخل بدن را آسانتر گرداند. بدین منظور مراقبتهای زیر را بکار بندید:
مراقبت از پوست:
– پوست را در مقابل جراحت و زخم محافظت کنید.
– هر گونه جوش ، تاول و قرمزی پوست را به رویت پزشک معالج برسانید.
– پوست را همواره تمیز و به کمک لوسیونها ، مرطوب نگه دارید.
– پوست مقعدکودکان سرطانی زیر دو سال به دلیل عدم توانایی در بیان زمان دفع ، بیشتر در معرض تماس با آلودگی قرار دارند ، بنابراین پس از دفع ناحیه تناسلی و مقعد را با دقت و آب کافی شستشو دهید و ناحیه را از نظر قرمزی و التهاب بررسی کنید.
– در طول دوره اشعه درمانی استفاده از کرم در ناحیه علامت گذاری شده ممنوع است ، اما می توانید با یک پارچه مرطوب پوست را به آرامی تمیز کنید.
– پوست بیماران سرطانی در مقابل نور خورشید آسیب پذیر است ، هنگام خارج شدن از منزل کلاه و لباس آستین داربپوشید.
مراقبت از دهان:
به طور مرتب از دهانشویه استفاده کنید.
جهت تهیه دهانشویه در منزل یک قاشق غذا خوری جوش شیرین و یک قاشق غذا خوری نمک را به چهار لیوان آب جوشیده سرد اضافه نموده پس از حل شدن در یخچال نگهداری کنید و در طی ۲۴ ساعت جهت دهانشویه استفاده کنید.
هر گونه زخم ، برفک وآزردگی حین بلع را به اطلاع پزشک معالج برسانید.
۸- گردگیری و نظافت منزل:
گرد و غبار روی اشیاء و اثاثیه منزل یکی از جاهایی است که قارچها در کمین بیمار سرطانی هستند. البته نباید این هشدار شما را به دلهره بیاندازد و از فردا با ذره بین به دنبال غبار بگردید. بلکه منظور اینست اگر مجبورید خانه را گرد گیری کنید دستکش و ماسک استفاده نمائید و اگر کودک سرطانی در منزل دارید , قبل از گرد گیری وی را از محیط دور کنید.
۹- روزانه دمای بیمار را هر ۱۲ ساعت یکبار اندازه گیری کنید.
برای اندازه گیری دما از دماسنج دیجیتال استفاده کنید . دماسنج را زیر بغل وی بگذارید و پس از شنیدن صدای آژیر (بیب) درجه را بخوانید. دمای زیر بغلی نیم درجه کمتر از دمای واقعی است ، بنابراین نیم درجه به دمای خوانده شده اضافه کنید.
دمای واقعی ۳۸ درجه ، تب محسوب می شود. اگر بیمار تب کرد اقدامات زیر را پیگیری کنید:
ابتدا دست و پای بیمار را با آب ولرم پاشویه کنید .
به بیمار مایعات ساده مانند: آب , آب میوه تازه و چای کمرنگ خنک بنوشانید.
وی را تشویق به دفع ادرار نمائید.
اگر با این اقدامات , تب کاهش پیدا نکرد ، با پزشک معالج خود تماس بگیرد و طبق دستور وی عمل نمائید.
در مواقعی که به پزشک معالج خود دسترسی ندارید ، بیمار را به بخش اورژانس بیمارستان ببرید.
۱۰-در منزل تهویه و دمای مناسب فراهم کنید.
دمای مناسب برای منزل ۲۸-۲۵ درجه سانتیگراد است و منزل باید از تهویه و رطوبت کافی برخوردار باشد.
۱۱ – از دادن سبزی خام ، کاهو و کلم به بیمار خودداری کنید.
احتمال آلودگی انگلی در سبزی ، کاهو و کلم به دلیل تماس نزدیک با خاک بسیار زیاد است ، سبزی های مذکور را تنها به صورت پخته (آش و سوپ) سرو کنید.
خطر آلوده شدن بیمار سرطانی با گوشت دام آلوده هم یکی از خطرات جدی است. پوست این بیماران بسیار شکننده و آسیب پذیر است ، که میکروبها می توانند به راحتی از طریق شکافهای ریز وارد بدن شده و وی را بیمار نمایند ، بنابراین اجازه ندهید بیمار سرطانی به گوشت خام دام و طیور بدون دستکش ، دست بزند.
۱۲- میوه هایی که از نظر شستشو دشوار هستند را به صورت کمپوت سرو کنید.
شستشوی برخی میوه ها مانند توت فرنگی و تمشک دشوار است ، اما محروم کردن کودک از خواص این میوه ها صحیح نیست ، شما به راحتی می توانید چنین میوه هایی را به صورت کمپوت خانگی به وی بخورانید.
۱۳- از مصرف مواد غذایی فله (بدون بسته بندی) خودداری کنید.
احتمال آلودگی قارچی و میرکوبی در مواد غذایی فله (بدون بسته بندی) به دلیل نحوه نگهداری بسیار بالاست ، خوشبختانه در بازار می توانید نمونه های بسته بندی هر ماده غذایی را که البته دارای پروانه بهداشتی هم باشند, تهیه کنید.
۱۴- از دادن غذاهای مانده و کهنه به بیمار خودداری کنید.
مواد غذایی محل مناسبی جهت رشد باکتریها و قارچها محسوب می شوند . نگهداری آنها حتی در یخچال هم می تواند فرصت رشد را فراهم نماید. بنابراین از دادن غذاهایی که بیش از ۵ ساعت از طبخ آنها گذشته است به بیمار خودداری کنید.
البته نگهداری مواد غذایی پخته در فریزر مانعی ندارد. مدت زمان نگهداری هر ماده غذایی در فریزر بهتر است مطابق جدول باشد. جدول طراحی شود.
۱۵- از دادن شیر محلی غیر پاستوریزه به بیمار خودداری کنید.
شیر غیر پاستوریزه یکی از منابع بالقوه آلودگی است ، مگر اینکه با شعله ملایم به مدت ۱۵ دقیقه جوشانیده شود ، که در بسیاری از مواقع امکان این مسئله میسر نیست ، بهتر است از شیرهای پاستوریزه و هموژنیزه موجود در بازار که مطمئن تر هستند استفاده نمائید.
۱۶ – از دادن تخم مرغ عسلی یا خام به بیمار خودداری کنید.
در کشور ما مردم باور دارند تخم مرغ نیم پخته (عسلی) برای گرفتگی صدا و عفونت ریه خوب است ، نمی خواهم وارد مبحث درست یا اشتباه بودن این باور شوم. اما نکته مهمتر اینست که احتمال آلودگی تخم مرغ به باکتری حسبه بسیار زیاد است و این آلودگی فقط با پختن کامل تخم مرغ قابل زدودن است.
۱۷- از دادن دانه به ، چهار تخم و سایر دمی های خریداری شده از عطاری ها که به بدون بسته بندی بهداشتی هستند به بیمار خود داری کنید.
متاسفانه نحوه نگهداری و استحصال این گونه داروهای گیاهی ، در بیشتر مواقع به درستی انجام نمی شود ، و با وجود مفید بودن ، برای بیمار سرطانی که مستعد عفونت است توصیه نمی شود. اما اگر دارای برچسب بهداشتی هستند مانعی ندارد.
۱۸- پانسمان روی آنژیوکت یا پورت را از مرطوب شدن محافظت کنید.
در همه بیماران بستری در بیمارستان و برخی که به صورت سرپایی و روزانه داروی تزریقی دریافت می کنند , از ابزارهای برقراری رگ استفاده می شود , که معمولاً با چسب و یک پانسمان کوچک محافظت می شود . نکته قابل توجه در مورد آنها اینکه نباید با آب خیس شوند , چون آب به عنوان یک سیال میکروبها را به محل ورودی پوست منتقل می نماید.
۱۹- موبایل منبع آلودگی است.
امروزه همه حداقل یک موبایل همراه خود دارند . تحقیقات نشان می دهد موبایلها یکی از آلوده ترین لوازم زندگی هستند. اما می توان با پنبه آغشته به الکل روزانه آنرا ضد عفونی کرد. کودکان معمولاً به موبایل والدین خود علاقمند هستند , توصیه می شود در کودکان سرطانی قبل از سپردن آن به کودک , با پنبه آغشته به الکل ضد عفونی شود.
۲۰- عدم تماس لوله ها و شیلنگ های سرم با زمین.
در روزهای بستری در بیمارستان هنگام نقل و انتقال مراقب شیلنگها و لوله های سرم باشید تا با زمین تماس پیدا نکند و آلوده نشوند.
۲۱- حیوانات خانگی و گل.
پرندگان قفسی و خانگی منشاء بسیاری از بیماریهای جدی هستند. لذا توصیه میشود جهت جلوگیری ازانتقال عفونت به بیمار ، از نگهداری چنین حیواناتی خودداری نمائید.
عادت دیگری که برخی خانواده ها دارند ، گذاشتن باقیمانده غذا پشت پنجره جهت کبوترهای وحشی است ، که بهتر است در منزلی که از بیمار سرطانی مراقبت می شود از این کار اجتناب شود. همچنین آوردن گل طبیعی برای بیمار سرطانی ممنوع است. نگهداری از گلدان گل طبیعی در منزل در صورتیکه از سلامت گل اطمینان ندارید هم توصیه نمی شود و نباید انجام شود.
۲۲- اسباب بازی .
یکی دیگر از منابع آلودگی اسباب بازیهای کودک هستند. در کودک سرطانی از اسباب بازی های قابل شستشو استفاده کنید و بطور مرتب آنها را بشوئید. خصوصاً اگر احتمال می دهید کودک آنها را به دهان خود وارد کند. در کودکان بزرگتر برایشان تفهیم کنید که بعد از بازی حتماً دستانشان را با آب و صابون بشویند.
۲۳- شنا در استخر ، دریا و استفاده از وان های ضد عفونی نشده و عمومی در بیمار سرطانی ممنوع است.
۲۴- آرایشگاه .
کوتاه کردن موها و استفاده از ماشین های شیو اشکالی ندارد ، اما لازم است برخی نکات در مورد آنها رعایت شود. قیچی ، شانه و روکش باید شخصی باشد که با قیمت مناسب می توان تهیه کرد. استفاده از تیغ در بیمار سرطانی به دلیل خطر خونریزی و عفونت ممنوع است و به جای تیغ باید از موزر های برقی استفاده شود که قبل و بعد از استفاده باید با پنبه الکلی تمیز شود. انجام برخی کارهای آرایشی مانند خالکوبی ، مانیکول ، پدیکول ، ناخن مصنوعی و هر کاری که احتمال وارد آمدن آسیب به پوست وجود دارد ، در بیمار سرطانی ممنوع است
۲۵- مراقبت از زخم.
اگر به هر دلیلی بیمار دچار جراحت شد ، باید ابتدا زخم را با بتادین و پنبه تمیز نموده سپس پانسمان نمائید. جراحات عمیق و جدی باید حتماً به اطلاع پزشک معالج رسانیده شود.
۲۶- یبوست.
داروهای شیمی درمانی ، بی اشتهایی و مسکن ها می توانند موجب یبوست در بیمار شوند ، در بخش عارضه یبوست به راه های مقابله و درمان یبوست اشاره شده است , که می توانید مطالعه بفرمائید.
اقدامات بعد از عفونت
نقش من در هنگام درمان عفونت چیست؟
اگر دچار عفونت شدید خودتان را سرزنش نکنید ، ۸۰ درصد از بیماران سرطانی در طول درمان حداقل یک بار دچار عفونت می شوند. حتی با رعایت نکاتی که در بالا ذکر شد ، به دلیل افت گلبولهای سفید احتمال ابتلاء به عفونت باز هم زیاد است.
میکروبها از هر راهی ممکن است وارد بدن بیمار شوند. حتی ممکن است تحت عنوان میکروبهای فرصت طلب از مدتها قبل در بدن بیمار پنهان باشند و اکنون با استفاده از فرصت ایجاد شده ناشی از ضعف سیستم ایمنی ، وی را دچار عفونت نمایند. با شناخت و بکار بردن برخی نکات و به کمک پزشک معالج و کادر درمان می توانید در مبارزه بر علیه عفونت همچنان نقش پر رنگی داشته باشید.
۱- توجه به دمای بیمار
تب یکی از نشانه های عفونت است. بنابراین اندازه گیری مرتب آن بسیار حائز اهمیت می باشد. خوشبختانه امروزه با وجود دماسنج های دیجیتال اندازه گیری تب بسیار آسان شده است.
تب از ۳۸ درجه شروع می شود ، بهتر است در نیم ساعت اول تنها اقدام برای پائین آوردن دما پاشویه ، مصرف مایعات فراوان و تشویق به دفع ادرار باشد.
جهت پاشویه از آب ولرم استفاده کنید و در ابتدا فقط دستها را تا زیر بغل و پاها را تا بخش میانی ران پاشویه نمائید.
در کودکان دمای بالای ۴۰ درجه می تواند خطر تشنج را به همراه داشته باشد بنابراین اگر در منزل هستید و تب با پاشویه و یک نوبت آستامینوفن همچنان رو به افزایش داشت ، حتماً با پزشک خود تماس بگیرید.
نکته حائز اهمیت دیگر اینکه بدن قادر به تحمل دمای بالای ۴۲ درجه سانتیگراد نیست و این مقدار تب کشنده است.
در صورتیکه با اقدامات بالا تب فروکش نکرد , حتماً با پزشک خود تماس بگیرید , یا به بیمارستان مراجعه کنید.
ایزوله معکوس یعنی چه؟
ایزوله به معنای جداسازی است. بیماری که تحت شرایط ایزوله قرار می گیرد ، باید از دیگران جدا شود و تماس و ارتباط وی فقط با کادر درمان و مراقب اصلی مجاز است .
ایزوله معکوس یعنی : بیمار از نظر سطح سیستم ایمنی بسیار ضعیف است و به سهولت می تواند از طریق سایرین دچار عفونت شود و به همین دلیل ملاقات با دیگران مطلقاً ممنوع می شود .
در چنین شرایطی وظیفه سایرین خصوصاً مراقب اصلی بیمار بسیار سنگین است. وی باید علاوه بر رعایت نکاتی که در بخش پیشگیری گفته شد ، به رعایت نکات دیگری هم همت بگمارد.
۲- استفاده از وسایل محافظتی
در شرایط ایزوله باید تمام مدتی که درکنار بیمار حضور دارید از وسایل محافظتی زیر استفاده نمائید.
ماسک : ماسک باید تمام دهان و بینی را بپوشاند و حداقل هر ۱۲ ساعت یکبار تعویض شود.
اگر لازم است جهت ارائه مراقبت بیمار را لمس کنید ، ابتدا دستانتان را به روش علمی بشوئید و پس از انجام اقدام مراقبتی مجدد شستشو را تکرار کنید.
در مرحله ایزوله معکوس بعد از شستشوی علمی باید از ضد عفونی کننده های مخصوص هم برای آبکشی مجدد استفاده شود..
اگر بیمار کودک است ، هنگام تعویض پوشک ، بعد از شستشوی دستان ، دستکش نایلونی بپوشید سپس مبادرت به تعویض وی نمائید.
اگر بیمار کودک است و لازم است ساعاتی از روز وی را در آغوش بگیرید ، حتماً از گان یکبار مصرف استفاده کنید و گان را روزانه تعویض کنید.
۳- ملاقات ممنوع
ملاقات با بیمار ایزوله ممنوع است. بنابراین اگر احتمال می دهید اقوام ممکن است برای ملاقات به بیمارستان مراجعه کنند حتماً به اطلاعشان برسانید.
مبحث افت گلبول سفید و عفونت طولانی شد , امیدواریم شما را خسته نکرده باشم. اما به دلیل اهمیت موضوع لازم بود همه نکات را به اطلاعتان می رسانید.
حتی اگر دچار عفونت شدید نگران نباشید , آنتی بیوتیک های قوی , روشهای دارویی افزایش گلبول سفید و استانداردهای بهداشتی _ مراقبتی , به شما در فائق آمدن بر این عارضه کمک خواهند کرد و به زودی وضعیت عادی پیدا می کنید.
چرا اندازه گیری دمای از طریق زیر بغل نسبت به دهان بهتر است؟
– اگر بیمار کودک باشد ، نگهداری دماسنج در دهان برایش دشوار است.
– اگر بیمار قبل از اندازه گیری غذا یا نوشیدنی گرم یا سرد خورده باشد می تواند در عدد دماسنج تاثیر بگذارد.
– وارد کردن دماسنج به دهان بهداشتی نیست و ممکن است همراه با آن آلودگی وارد دهان بیمار شود.
* اما اندازه گیری دما از طریق زیر بغل دارای نکته ای هم هست. دمای زیر بغل کمتر از دمای داخل بدن است و باید به عدد نمایش داده شده ۰/۷ اضافه شود یعنی اگر دمای زیر بغل بیماری ۳۷/۲ درجه سانتیگراد است ، دمای واقعی بدن وی ۳۷/۹ می باشد.
موضوعات مرتبط: هماتولوژي
در حالی که عامل اصلی و واقعی بیماری سرطان خون ناشناخته است؛ اما در عین حال دانشمندان و پزشکان بر این باورند که ترکیبی از عوامل ژنتیکی و محیطی در این بیماری نقش دارند.
عوامل خطر شامل مواردی همچون سیگار کشیدن، پرتو یونی، برخی مواد شیمیایی (از قبیل بنزن)، سابقهٔ شیمیدرمانی و نشانگان داون میشود.
افرادی که در خانوادهٔ خود سابقهٔ بیماری سرطان خون را داشتهاند، نیز از خطر زیادی برخوردارند.
استفاده از حشره کش های خانگی احتمال ابتلای کودکان به سرطان خون را ۴۷ درصد و لنفوم را ۴۳ درصد افزایش می دهد.مطالعات محققان مدرسه بهداشت عمومی بوستون آمریکا نشان می دهد که تاثیر مخرب آفت کش ها بر بدن کودکان بیشتر از بزرگسالان است؛ زیرا سیستم ایمنی کودکان هنوز به طور کامل توسعه نیافته است و نمی تواند سم زدایی کند.
چهار نوع اصلی سرطان خون وجود دارد:
لوسمی حاد لنفوئیدی (ALL)، لوسمی حاد میلوئیدی (AML)، لوسمی مزمن لنفوئیدی (CLL) و لوسمی مزمن میلوئیدی (CML). همچنین انواع دیگری هم هستند که رواج کمتری دارند.
سرطان خون بخشی از یک گروه وسیعتر به نام نئوپلاسم است که شامل خون، مغز استخوان و سیستم لنفوئیدی میشود که به تومورهای بافتهای خونساز و لنفوئیدی معروف هستند.
درمان این بیماری شامل ترکیبهایی از روشهای شیمیدرمانی، پرتودرمانی، درمان هدفمند، پیوند مغز استخوان و همچنین مراقبت تسکینی میشود. انواع خاص بیماری سرطان خون با انتظار هوشیارانه درمان میشود.
خون یا فرآورده پلاکتی و همچنین کلینیک درد ممکن است مورد نیاز باشد.این امکان وجود دارد که مراقبت تسکینی «با» یا «بدون» تلاش برای کنترل بیماری مورد نیاز باشد.
موفقیت در درمان به نوع سرطان خون و سن شخص بستگی دارد. نتیجه درمان در کشورهای توسعهیافته بهتر شده است. میانگین میزان بقای پنج ساله در ایالات متحده ۵۷ درصد است. در کودکان کمتر از پانزده سال، میزان بقای پنج ساله بیش از ۶۰ تا۸۵ درصد است که این امر به نوع سرطان خون بستگی دارد. در افرادی که دچار لوسمی حاد هستند و بعد از پنج سال از سرطان رهایی مییابند، امکان بازگشت سرطان نامحتمل است.
در سال ۲۰۱۲ سرطان خون در ۳۵۲ هزار نفر در سراسر دنیا ایجاد شد و از این میان باعث مرگ ۲۶۵ هزار نفر گردید. این بیماری معمولترین نوع سرطان در میان کودکان است که سه چهارم موارد سرطان خون در کودکان اتفاق میافتد و همگی از نوع لوسمی لنفوبلاستی حاد (ALL) است. اما تقریباً ۹۰ درصد انواع سرطان خون در بزرگسالان تشخیص داده میشود که انواع لوسمی حاد میلوئیدی (AML) و لوسمی لنفوسیتی مزمن (CLL) معمولترین انواع در بزرگسالان میباشند. این بیماری در کشورهای توسعهیافته بیشتر اتفاق میافتد.
محتویات
۱ نشانهها
۲ انواع
۳ آسیب شناسی
۴ روند تشخیص
۵ درمان
۶ منابع
نشانهها
نشانههای نمادین لوکمی موارد زیر میباشند: کمخونی که با رنگ پریدگی و سستی یا خستگی مشخص میشود، کبودی پوست،تهوع، لثههای متورم و خونین، تب خفیف (۳۸/۵ درجه). غدههای لنفاوی متورم (با اینکه غدهها نه دردناک و نه قرمز میباشند). درد استخوان، خونریزی شدید و پیدرپی و پدیدار شدن خون در ادرار یا مدفوع کودک.
نشانههایی همانند علایم لوکمی میتوانند در کودکانی که از اختلالات گوناگون دیگری رنج میبرند نیز ظاهر شوند. پزشکان وقتی به لوکمی مشکوک میشوند که نشانهها نمادین آن با بزرگی جگر یا طحال همراه باشند. هنگامی شک بیشتر میشود که سلولهای سفید سرطانی در لام خون محیطی دیده شود. تشخیص با آزمایش مغز استخوان قطعی میشود.
انواع
لوسمی بر اساس نوع گویچه سفید خون که دچار تراریختگی(ترانسژن) و سرطان شده به دو دسته تقسیم میشود:
لنفوئیدی یا لنفوبلاستی:
این نوع لوسمی سلولهای لنفاوی یا لنفوسیتها را تحت تاثیر قرار میدهد که بافتهای لنفاوی را میسازند. این بافت جزء اصلی سیستم ایمنی بدن است و در قسمتهای مختلف بدن از جمله غدد لنفاوی، طحال یا لوزهها یافت میشود.
میلوئیدی یا مغز استخوانی:
این نوع لوسمی سلولهای مغز استخوانی را تخت تاثیر قرار میدهند. سلولهای مغز استخوان شامل سلولهایی است که بعداً به گلبولهای قرمز، گلبولهای سفید و سلولهای پلاکت ساز تبدیل میشوند.
همچنین هر دو دسته لوسمی به دو نوع حاد و مزمن تقسیم می شوند لذا چهار نوع کلی لوسمی داریم لوسمی مزمن میلوئیدی ، لوسمی حاد میلوئیدی ، لوسمی مزمن لنفوئیدی و لوسمی حاد لنفوئیدی (ALL، CLL، AML، CML)
آسیب شناسی
پزشکان علت دقیق لوسمی را نمیدانند. به نظر میرسد عوامل ژنتیکی و محیطی در بوجود آمدن این بیماری نقش داشته باشند. مانند هر سرطان دیگری، عامل مستعد و پیشتاز در ایجاد لوسمی به هم خوردن نظم تقسیم سلولی است. پژوهشهای انجام شده روند بدخیمی بیماری لوسمی را به این عوامل ارتباط میدهند:
ژنتیک:
ناهنجاریهای ژنتیکی نقش بسیار مهمی در رشد لوکمی در بدن دارد. برخی بیماریهای ژنتیکی مثل سندرم داون، احتمال ابتلا به لوکمی را بالا میبرد.
قرار گرفتن در معرض پرتوهای یونیزه کننده و برخی مواد شیمیایی خاص: افرادی که در معرض پرتوهای شدید قرار گیرند مانند بازماندگان بعد از حملات اتمی یا رویدادهای رآکتورهای هستهای، احتمال دچار شدن به لوکمی در آنها بیشتر است. قرار گرفتن در معرض برخی موادشیمیایی خاص مانند بنزن نیز میتواند احتمال ابتلا به لوکمی را افزایش دهد.
نارسایی سیستم ایمنی طبیعی بدن
سن در میان بزرگسالان: آمادگی ابتلا به لوسمی با افزایش سن ارتباط مستقیم دارد. افراد بالای ۵۵ سال باید بیشتر مراقب علایم هشدار دهنده این بیماری باشند. با این حال لوسمی میتواند کودکان را هم در هر سنی گرفتار کند ولی بیشتر در سنین سه تا چهار سال اتفاق میافتد.
روند تشخیص
بیماری میتواند با شتاب یا به کندی پیشرفت کند. نزدیک ۲۵ درصد گونههای لوکمی در جریان یک معاینه بالینی معمولی و پیش از اینکه نشانهها بیماری ظاهر شوند تشخیص داده میشوند.[نیازمند منبع]پزشکان معمولاً لوکمی مزمن را با آزمایش خون ساده قبل از شروع علائم تشخیص میدهند. روند تشخیص میتواند دربرگیرنده موارد زیر باشد:
آزمایش جسمی:
شناسایی نشانههای فیزیکی و جسمی لوکمی مثل رنگپریدگی ناشی از کم خونی، و ورم غدههای لنفاوی، کبد یا طحال
آزمایش خون:
شمارش تعداد گلوبولهای سفید یا پلاکتهای خون
آزمایش سیتوژنتیک:
این آزمایش تغییرات ایجاد شده در کروموزومها، ازجمله وجود کروموزوم فیلادلفیا را بررسی میکند.
آزمایش نمونه مغزاستخوان
برای تایید تشخیص لوکمی و تعیین نوع و میزان پیشرفت آن دربدن، نیاز به آزمایشهای بیشتر است.
درمان
در سالهای اخیر، با به کارگیری داروهای ضد سرطان موثرتر، طول عمر بیماران مبتلا به لوکمی افزایش پیدا کرده است. این داروها موجب فروکش کردن نشانههای بیماری میگردند به طوریکه نشانهها در جریان درمان بیماری بدتر نمیشود و حتی بیماران تا اندازهای درمان میشوند.
درمان لوسمی بستگی به نوع لوسمی، وضعیت بیماری در شروع درمان، سن، سلامت عمومی و چگونگی واکنش بیمار به نوع درمان دارد که گاهی منجر به سلامت کامل این بیماران میشود . از مهمترین عوامل در بهبود بیماری برخوردار بودن بیمار از روحیه بالا جهت مقابله با این بیماری است .
شیوه درمان این بیماری میتواند شامل موارد زیر نیز باشد:
– شیمی درمانی
– پرتو درمانی
پیوند مغز استخوان و پیوند سلولهای بنیادی که در این روش مغز استخوان فرد بیمار با مغز استخوان سالم جایگزین میشود تا بیمار بتواند مقادیر بالای داروهای شیمی درمانی و یا پرتودرمانی را دریافت کند.
یافته های اخیر محققان دانشگاه کرنل نشان داد که با استفاده ازفناوری نانولوله می توان سلول های سرطانی موجود در جریان خون را به دام انداخت.
آزمایشگاه مایل کینگ این دانشگاه روی سلول های سرطانی تحقیق می کند و اخیرا از نانولوله های هالویسایت (HNT) به عنوان نانوساختاری برای به دام اندازی سلول های تومور موجود در خون استفاده کرده است، این سلول ها موجب گسترش سرطان در بدن می شوند. این دستاورد علمی موجب شده است تا امیدهای زیادی برای درمان انواع مختلف سرطان ایجاد شود.
نشریه نیچر نتایج یک مطالعه پزشکی در مورد لوسمی میلوئید مزمن (CML) که از نادرترین انواع سرطان خون است را منتشر و اعلام کرد که ترکیب یکی از داروهای دیابت با داروهای استاندارد درمان سرطان خون، در درمان بهتر بیماران موثر است.
در این مطالعه ۲۴ بیمار مبتلا به CML که به درمان های رایج پاسخ نداده بودند، با ترکیب داروی ضد دیابت پیوگلیتازون و داروهای رایج شیمی درمانی، مجددا درمان شدند.
پس از ۱۲ ماه بیش از ۵۰ درصد داوطلبان بهبود یافتند و بیماری ۳ نفر پس از گذشت ۵ سال عود مجدد نداشت و ظاهرا درمان شده بود.
بتازگی سازمان غذا و داروی آمریکا (FDA) داروی جدید درمان سرطان خون را تایید کرد. این دارو Empliciti نام دارد و محصول شرکت های دارویی Bristol-Myers و AbbVie است و سیستم ایمنی بدن را به گونه ای تربیت می کند که با سخت ترین نوع بیماری سرطان خون مبارزه کند .
سرطان خون حاد
ترکیب خونی بیمار طی ۶-۳ هفته کاملا به هم می خورد و علایم بالینی از جمله افت پلاکت، کاهش گلبول های قرمز یا افزایش گلبول های سفید، تب و نشانه های نارسایی مغزاستخوان سریع خود را نشان می دهد. پلاکت پایین، تنگی نفس، خونریزی، کاهش وزن و عفونت، بیمار را از کار و زندگی می اندازد و به پزشک مراجعه می کند. احتمال ابتلا به این بیماری، ۳ در هر ۱۰۰ هزار نفر جمعیت است. سرطان خون حاد دو نوع میلوییدی (AML) و لنفوییدی (ALL) دارد و با توجه به نوع سلول سرطانی، درمان و نوع علایم آنها با هم متفاوت هستند.
درمان اصلی شیمی درمانی است. باید از مغزاستخوان بیمار نمونه برداری و ظرف ۴۸ ساعت تصمیم گیری و شیمی درمانی شروع شود. پاسخ به درمان خیلی خوب است و بیماری کاملا از مغزاستخوان پاک می شود، از آنجا که بیماری در بیشتر بیماران بعد از تقریبا ۱ سال، به علت اینکه تعداد کمی از سلول ها به صورت خفته و نیم فعال در مغزاستخوان باقی می مانند و شیمی درمانی قادر به از بین بردن سلول های نیمه فعال نیست، عود می کند، اگر بیماران پیگیری نشوند و اقدام به موقع انجام نگیرد، متاسفانه در عود اول و دوم، از شیمی درمانی نتیجه نخواهیم گرفت.
گام بعد از شیمی درمانی
بعد از شیمی درمانی سنگین، باید درمان پیشرفته تر پیوند سلول های بنیادی مغزاستخوان انجام شود و بعد از اینکه پلاکت و گلبول های سفید و قرمز طبیعی شدند (تقریبا ۲ ماه طول می کشد) و توانستیم مغز استخوان را کامل فلج کنیم، مرحله بعدی، پیوند مغزاستخوان است و از خواهر، برادر یا از پدر و مادر بیمار و طبق شرایط خاصی پیوند دریافت می شود. البته از دهندگان غریبه نیز به ندرت می توان مغزاستخوان سالم را گرفت و به بیماران تزریق کرد. به این ترتیب می توان از عود مجدد سرطان هم جلوگیری کرد
. درمان سرطان خون حاد، ترکیبی از شیمی درمانی و پیوند مغزاستخوان است و اگر به خوبی و به موقع انجام شود، تقریبا ۷۰ درصد بیماران از بیماری جان سالم به در می برند.
سرطان خون مزمن
برخلاف نوع حاد، سیر بیماری و بروز علایم بالینی در سرطان خون مزمن بسیار کند پیش می رود و ممکن است فرد مبتلا به سرطان مدت های طولانی از وجود سلول های سرطانی در بدنش بی اطلاع باشد. علایم نیز بسیار خفیف و جزئی است. ضعف، بی حالی و بزرگی طحال جزو نشانه های این بیماری است. گاهی بیماران به علت بزرگی طحال به پزشک مراجعه می کنند و بیماری سرطان خون تشیخص داده می شود. در بزرگسالان برعکس کودکان، سرطان خون مزمن شایع تر است. سرطان خون مزمن دو نوع میلوپرولیفراتیو (CML) و لنفوپرولیفراتیو (CLL) دارد.
درمان
خوشبختانه سرطان خون مزمن نوع CML با دارویی که ۹-۸ سال است وارد ایران شده، درمان می شود. قرص باید طولانی مدت (حداقل ۵ سال) و روزی ۴ عدد مصرف شود و بیماران با این درمان دارویی زندگی طبیعی را از سر می گیرند. نوع CLL در افراد بالای ۴۰ سال دیده می شود و درمان آن پیچیده تر است. البته خیلی از بیماران بعد از کشف و تشخیص بیماری به درمان خاصی نیاز ندارند. CLL بیماری کم ضرری برای بدن محسوب می شود و بدن واکنش خاصی به آن نشان نمی دهد ولی به ندرت افزایش گلبول های سفید، کم خونی و ضعف در فرد مبتلا دیده می شود.
گاه فقط لازم است بیمار ۶-۵ سال تحت نظر بماند و به درمان سریع نیاز نیست. فقط نام این نوع از سرطان خشن و نگران کننده است. اقدام پزشکی زمانی ضرورت می یابد که بیماری کمی فعال شود و علایم ژنتیکی خاص خود را نشان دهد.
موضوعات مرتبط: هماتولوژي
این بیماری میلیون ها نفر را در جهان و حدود ۷۲ هزار نفر را در آمریکا مبتلا ساخته است. این بیماری در یک تولد از هر ۵۰۰ تولد آفریقایی- آمریکایی دیده می شود.
سلولهای هموگلوبین سلول داسی سفت و به شکل داس میباشند. این مولکولهای هموگلوبین تمایل دارند به شکل خوشهای و در کنار یکدیگر قرار گیرند، بنابراین به راحتی از مویرگهای خونی عبور نمیکنند. این خوشهها منجر به توقف جریان خون حملکننده اکسیژن میگردند.
برخلاف سلولها با هموگلوبین طبیعی که بیش از ۱۲۰ روز زنده هستند، سلولهای داسی بعد از ۲۰-۱۰ روز از بین میروند. این روند طی یک دوره مزمن منجر به بروز کم خونی میگردد.
کم خونی داسی شکل حاصل یک جهش ژنی میباشد که طی آن یک نوکلئوتید با باز آلی تیمین جای خود را با یک نوکلئوتید دیگر با باز آلی آدنین عوض میکند.
پژوهشگران پزشکی می گویند سلولهای داسیشکل ممکن است در اثر کمبودشان در خون، مجبور شوند که به سلولهای سرطانی تمورهایی که در برابر درمان مقاومت میکنند، حمله کنند. این سیستم روشی نو برای درمان سرطان گزارش شده است
شایعترین انواع ژن سلول داسی
- صفت سلول داسی:
این افراد حامل ژن معیوب – Hbs – هستند اما مقداری هموگلوبین طبیعی – Hba– نیز دارند افراد با صفت سلول داسی معمولاً بدون علامت هستند و میباشند. ممکن است کم خونی خفیف ایجاد گردد.
تحت شرایط پر استرس، خستگی، کاهش اکسیژن و یا عفونت روند داسی شدن رخ میدهد و در نتیجه عوارض بیماری سلول داسی بروز مینماید.
- بیماری سلول داسی – هموگلوبین C
فرد دارای هر دو نوع همگلوبین Hbs وHbc میباشد. هموگلوبین C باعث ایجاد سلولهای هدف میگردد. وجود هموگلوبین طبیعی در کنار این هموگلوبین باعث میشود، فرد علامتی از کم خونی نداشته باشد.
اگر هموگلوبین S داسی با سلول هدف همراه شود منجر به یک کم خونی خفیف تا متوسط میگردد.
این افراد اغلب از بیماری سلول داسی با درجه خفیف رنج میبرند.بحران گرفتگی رگها، صدمات ارگانها به علت کم خونی و داسی شدنهای مکرر و احتمال بالای عفونت همه صفات مشترکی برای Hbss و Hbsc میباشند.
- بیماری سلول داسی – هموگلوبین E
این نوع مشابه بیماری سلول داسی C است با این تفاوت که یک عنصر در ملکول هموگلوبین جایگزین شدهاست. این نوع معمولاً در افراد جنوب آسیا مشاهده میشود. برخی افراد با بیماری هموگلوبین E بدون علامت میباشند. هر چند تحت شرایط ویژه نظیر خستگی، کاهش اکسیژن و یا کمبود آهن یک کم خونی خفیف تا متوسط بروز مینماید.
- هموگلوبین S – تالاسمی بتا:
این بیماری با ارث رسیدن همزمان ژنهای تالاسمی و سلول داسی ایجاد میگردد.
این اختلال باعث کم خونی متوسط و شرایطی مشابه ولی خفیف تر از بیماری سلول داسی میگردد.
همه اشکال بیماری سلول داسی میتوانند عوارض همراه با بیماری را بروز دهند. فرد مبتلا به Hbss به شدت مبتلا خواهد بود.
چه کسی به بیماری سلول داسی مبتلا میشود؟
بیماری سلول داسی به صورت اولیه، افراد جنوب آفریقا و شبه جزیره کارائیب را مبتلا میسازد ولی صفت سلول داسی در خاور میانه، هند، آمریکای لاتین، و نژاد مدیترانهای یافت میشود.
براساس تخمین، بیش از ۷۲ هزار نفر در ایالات متحده به این بیماری مبتلا هستند. میلیونها نفر در سراسر جهان از عوارض بیماری سلول داسی رنج میبرند. ۲ میلیون نفر آفریقایی – آمریکایی یا ۱۲/۱ جمعیت آمریکا صفت سلول داسی دارند.
علل بیماری داسی شکل چیست؟
بیماری داسی یک بیماری ارثی است که توسط یک جهش ژنتیکی ایجاد میشود. این ژنها بر روی ساختاری از سلولها به کروموزم وجود دارند. جفت کرموزوم ۱۱ حاوی ژنهای مسئول تولید هموگلوبین نرمال میباشد.
یک جهش در این ژنها منجر به بیماری داسی شکل میشود. این جهش در نقاطی از جهان که بیماری مالاریا شایع است بیشتر دیده میشود هر چندافراد دارای صفت داسی به مالاریا مبتلا نمیشوند. صفت داسی حقیقتاً فرد را در برابر انگل مالاریا محافظت مینماید. مالاریا اغلب در آفریقا و نواحی مدیترانهای اروپا دیده میشود.
کودکی که جهش ژنتیکی را از هر دو والدین به ارث میبرد، بیماری سلول داسی شکل مبتلا خواهد شد.
کودکی که جهش را از یکی از والدین به ارث میبرد به حامل صفت سلول داسی شکل خواهد بود و میتواند آن را به فرزندانش منتقل سازد.
تشخیص
علاوه بر شرح حال کامل پزشکی فرد و معاینه بدنی، روشهای تشخیصی بیماری سلول داسی شکل عبارتند از : آزمایشهای خونی و دیگر روشهای ارزیابی.
هم اکنون غربالگری آزمایش خون نوزادان، به منظور شروع هرچه سریعتر درمان صورت میگیرد.
الکتروفورز هموگلوبین یک آزمایش خونی است که در تشخیص افراد حامل صفت داسی شکل و یا هر بیماری همراه با سلول داسی شکل، کمک می کند.
علائم بیماری سلول داسی شکل چیست؟
هنگامی که بدن با کمبود اکسیژن مواجه شود، گلبولهای قرمز تغییر شکل میدهند و به شکل داس در میآیند و در عروق ریز و باریک گیر میکنند و باعث درد شدیدی در اعضای مختلف بدن میشوند.
بیماری داسی یک بیماری ارثی است که توسط یک جهش ژنتیکی ایجاد میشود. این ژنها بر روی ساختاری از سلول ها به نام کروموزم وجود دارند. به طور طبیعی در هر سلول بدن ما ۴۶ عدد یا ۲۳ جفت کرموزم وجود دارد. جفت کرموزوم ۱۱ حاوی ژنهای مسئول تولید هموگلوبین طبیعی میباشد. یک جهش یا اشتباه در این ژنها منجر به بروز بیماری داسی شکل میشود.
این جهش در نقاطی از جهان که بیماری مالاریا شایع است، بیشتر دیده میشود، هر چند این افراد به مالاریا مبتلا نمیشوند. صفت داسی از فرد در برابر انگل مالاریا محافظت مینماید. مالاریا اغلب در آفریقا و نواحی مدیترانهای اروپا دیده میشود.
کودکی که جهش ژنتیکی را از هر دو والدین به ارث میبرد، به بیماری سلول داسی شکل مبتلا خواهد شد. کودکی که جهش را از یکی از والدین به ارث میبرد، حامل صفت سلول داسی شکل خواهد بود و میتواند آن را به فرزندانش منتقل سازد.
علائم و عوارض زیر با بیماری سلول داسی شکل همراه میباشد. هر چند هر فرد علائم متفاوتی را تجربه میکند.
آنمی – شایعترین علامت بیماری سلول داسی شکل است. در این بیماری سلولهای قرمز خون بصورت سلول داسی شکل تولید میشوند، اما به علت بدشکل بودن توانایی حمل اکسیژن را از دست میدهند. در نتیجه بدن آب را از دست داده و دچار تب میشود.
شکل داسی باعث سختی سلولها و دام افتادن آنها در رگها میگردد.
در نتیجه سلولها در طحال تخریب میشوند و یا به علت عملکرد غیر طبیعی از بین میروند و کاهش در سلولهای قرمز خونی منجر به کم خونی میشود. کم خونی شدید فرد را خسته و رنگ پریده مینماید، همچنین توانایی حمل اکسیژن به بافتها را با مشکل رو به رو خواهد کرد.
عوارض
عوارض به دو شکل حاد و مزمن دیده میشوند:
عوارض حاد:
اکثر عوارض حاد بیماری سلول داسیشکل مربوط به انسداد عروق است. درد زیاد در اعضایی که عروق ریز آنها مسدود شده است ایجاد میشود. این درد در هر نقطه از بدن ممکن است ایجاد شود اما در قفسه سینه، شکم و پشت شیوع بیشتری دارد. معمولا عفونت، کم آبی، تغییرات سریع دما و حاملگی زمینه ساز بروز این دردها هستند.
از دیگر عوارض عمده آن، حوادث عروق مغزی میباشد که در کودکان به علت انسداد عروق مغزی ایجاد سکته مغزی مینماید و در بزرگسالان باعث سکتههای مغزی خونریزی دهنده میشود.
از عوارض حاد دیگر بیماری میتوان عفونت استخوان را نام برد.
داسی شدن گلبولهای قرمز مکررا در طحال بروز میکند که به مروز زمان عملکرد طحال از بین میرود.این امر بیمار مبتلا را مستعد ابتلای به عفونت مینماید.
عوارض مزمن :
بیماری سلول داسی شکل همواره بیماری دوران کودکی بوده است. با افزایش طول عمر بیماران، تعداد بیشتری از آنها تا سنین بزرگسالی زنده ماندهاند و با مطالعه این افراد روشن شده است که آسیب ناشی از انسداد عروقی تقریباً تمامی اعضای انتهایی را درگیر میکند. نارسایی کلیه و ریه علل عمده مرگ در بیماران بزرگسال هستند.
سایر عوارض طولانی مدت عبارتند از : زخمهای پوستی مزمن، اختلالات چشمی، اختلال عملکرد کبد و سنگهای کیسه صفرا.
مروری بر عوارض :
بحران درد یا بحران داسی:
هنگامی که رگها خونی توسط سلولهای داسی شکل مسدود میشوند و جریان خون قطع میشود و بحران درد رخ میدهد که بحران گرفتگی رگها نیز نامیده میشود. درد در تمام نقاط بدن ایجاد میگردد اما اغلب در قفسه سینه، بازوها و پاها احساس میگردد.
تورم دردناک انگشتان دست و پا، که داکتیلیت نامیده میشود و میتواند در خردسالان و اطفال زیر ۳ سال مشاهده شود.
پریاپیسم (نعوظ دردناک) نیز که یک روند درناک در ناحیه آلت تناسلی مردان میباشد ممکن است پیش آید. هرگونه اختلال در جریان خون منجر به درد، تورم و مرگ بافتی در اثر عدم دریافت خون و اکسیژن کافی میگردد.
سندرم قفسه سینه حاد:
یکی از عوارض خطرناک بیماری سلول داسی شکل، روند داسی شدن در قفسه سینه میباشد. معمولاً به طور ناگهانی و در شرایط پراسترس، عفونت، تب و کم آبی بدن رخ میدهد.سلولهای داسی شکل به یکدیگر متصل گشته و رگها ریز ریوی را مسدود میسازند.
علائم شبیه به پنومونی و شامل تب، درد و تک سرفه شدید میباشد. اپیزودهای متعدد سندرم سینه منجر به صدمه دائمی ریه میگردند.
تجمع سلولهای خونی در طحال:
این فرآیند منجر به کاهش ناگهانی هموگلوبین گشته ودر صورت عدم درمان فوری تهدید کننده حیات میباشد. بدلیل افزایش حجم خون طحال، این عضو بزرگ و دردناک میگردد. بعد از اپیزودهای مکرر، صدمات جدی بر طحال وارد خواهد شد.
بسیاری از کودکان مبتلا به بیماری در سن ۸ سالگی دیگر طحال کارایی ندارند چون از طریق جراحی طحال خارج شده و یا دراثر اپیزودهای مکرر عملکرد خود را از دست دادهاست.
احتمال عفونت بزرگترین نگرانی برای اطفال مذکور میباشد. عفونت شایعترین علت مرگ در کودکان زیر ۵ سال، در این گروه میباشد.
سکته:
دیگر عارضه شدید و ناگهانی در بیماران سلول داسی شکل است. سلولهای بد شکل از طریق گرفتگی رگها خونی بزرگ تغذیه کننده مغز منجر به سکته میگردند. هرگونه اختلال در جریان خون و اکسیژن به مغز منجر به اختلالات عصبی غیرقابل بازگشت میگردد.
در ۶۰٪ بیمارانی که یک بار سکته کردهاند احتمال سکته دوم و سوم نیز وجود دارد.
یرقان، یا زردی پوست، چشمها و دهان:
یکی از شایعترین علائم و نشانههای بیماری سلول داسی شکل میباشد، سلولهای داسی شکل به اندازه سلولهای قرمز خونی عمر نمیکند و قبل از این که کبد آنها را از خون تصفیه نماید سریعاً از بین میروند. بیلی روبین (عامل زرد رنگی) ایجاد شده از این سلولها منجر به یرقان و زردی میگردد.
همه ارگانهای مهم تحت تأثیر این بیماری قرار میگیرند. کبد، قلب، کلیهها، کیسه صفرا، چشمها، استخوانها و مفاصل به علت عملکرد غیر طبیعی سلولهای داسی شکل و عدم وجود جریان خون د ررگها صدمه میبیند. مشکلات عبارتاند از:
- افزایش عفونتها
- زخمهای پا
- صدمات استخوانی
- سنگهای صفراوی
- صدمات کلیه و کاهش ادرار
- صدمات چشمی
علائم بیماری سلول داسی شکل ممکن است مشابه دیگر اختلالات خونی و مشکلات طبی باشد. همیشه جهت یک تشخیص سریع و دقیق با پزشک خود مشاوره نماید.
بیماری سلول داسی شکل چگونه تشخیص داده میشود؟
علاوه بر شرح حال پزشکی کامل و معاینه فیزیکی روشهای تشخیصی بیماری سلول داسی شکل عبارتاند از آزمایشهای خونی و دیگر روشهای ارزیابی.
هم اکنون غربالگری آزمایش خون نوزادان به منظور شروع درمان هرچه سریعتر صورت میگیرد.
تشخیص اولیه:
الکتروفورز هموگلوبین یک آزمایش خونی است که در تشخیص حاملین صفت داسی شکل و یا هر بیماری همراه با سلول داسی شکل کمک کنندهاست.
درمان
دردها با تجویز مایعات، اکسیژن و داروهای ضد درد کنترل میشوند. در صورت وجود هر گونه عفونت، مصرف آنتی بیوتیک لازم است.
در بیماران مبتلا به سندرم حاد قفسه سینه و یا درد مقاوم به درمان، پزشکان اقدام به تعویض خون مینمایند.
موضوعات مرتبط: هماتولوژي
فرایند انغقاد خون به جلوگیری از خونریزی بیش از حد کمک مینماید.انواع مختلفی از هموفیلی وجود دارد اما شایع ترین و شناخته شده ترین آنها عبارتند از:
هموفیلیA – کمبود فاکتور ۸
هموفیلیB- کمبود فاکتور ۹
هموفیلی هاگمن - کمبود فاکتور ۱۲
ون ویلبراند – عدم وجود فاکتور8
موضوعات مرتبط: هماتولوژي
ادامه مطلب
موضوعات مرتبط: هماتولوژي
موضوعات مرتبط: هماتولوژي
 |
به گزارش ايسنا، سرپرست درمانگاه شبانهروزي بيماران هموفيلي مجتمع بيمارستاني امامخميني(ره) با تاکيد بر اينکه افرادي که در خانواده سابقه بيماري هموفيلي هستند فرزندان خود را به منظور انجام اقدامات پيشگيرانه به پزشک مراجعه دهند گفت: افرادي که به موقع بيماري آنها تشخيص داده شود با انجام اقدامات پيشگيرانه سطح اوليه، که تزريق سه مرتبه فاکتورهاي 7 و 8 در هفته است، ميتوانند کيفيت زندگي خود را ارتقا و از بروز خونريزيهاي مکرر در مفاصل خود جلوگيري کنند.
دکتر محمد رضا منقچي، بيماران هموفيلي را جزو بيماراني دانست که عوارض انعقادي زيادي را به خود اختصاص داده اند افزود: محدوديتهاي درد هميشگي مفاصل يکي از مهمترين مشکلات جانبي اين بيماران است که در نتيجه اين درد، مفاصل اين بيماران به تدريج تحليل و در نتيجه دچار معلوليت و به سمت از کار افتادگي مي روند.
وي در ادامه با تاکيد بر اينکه ويروسهاي تزريق شده سابق بسياري از بيماران هموفيلي را به کام مرگ کشانده است تصريح کرد: مقداري از ويروسهايي که از سابق براي اين بيماران تزريق شده است باعث شده کبد اين بيماران کم کار و برخي از آنها از بيماريهاي ايدز، هپاتيت B و غيره رنج ببرند بطوريکه اين ويروسها منجر به فوت بسياري از اين بيماران شده است.دکتر منقچي با بيان اينکه نبايد اجازه داد بيماران هموفيلي سربار خانواده ها و جامعه قرار بگيرند گفت: خوشبختانه با توليد داروهاي جديد، مي توان اميدوار شد طول عمر اين بيماران با تفاوت تقربيا اندک با افراد عادي قرار دارد اما نگراني که در خصوص اين بيماران وجود دارد کيفيت زندگي آنها است که بايد با انجام اقدامات پيشگيرانه از بروز معلوليت در اين افراد جلوگيري کرد.
سرپرست اورژانس بيماران هموفيلي مجتمع بيمارستاني امام خميني(ره) ادامه داد: برخي از بيماران هموفيلي به دليل خونريزيهاي مکرر مفاصل و يا زندگي در زمان هايي که جامعه دچار کمبود فاکتورهاي انعقادي بود از همان اوايل جواني دچار معلوليت شدند که اميدواريم با توليدات داخلي اين کمبود ها را جبران کنيم تا اقدامات پيشگيرانه براي بيماران انجام شود.
وي همچنين اقدامات پيشگيرانه براي بيماران هموفيلي را در دو سطح اوليه و ثانويه تعريف کرد و گفت: در پيشگيري سطح اوليه فرد قبل از اينکه دچار خونريزي شود مورد درمان پيشگيرانه قرار مي دهيم بطوريکه اين بيماران بايد هفتهاي دو تا سه نوبت فاکتور 7 و 8 و همچنين هموفيلي هاي A و B نيز هفته اي يک نوبت فاکتور 9 تزريق کنند. اين اقدامات باعث مي شود که سطح فاکتور انعقادي در بدن به حدي بالا برود تا بتوانند يک زندگي عادي را داشته باشند.دکتر منقچي در خصوص سطح ثانويه پيشگيري اين بيماران نيز اظهار کرد: در نوع پيشگيري فرد بعد از يک مدت که دچار مشکلات مفاصل مي شود اقدامات پيشگيرانه انجام مي دهد بطوريکه در اين سطح از پيشگيري کيفيت زندگي بيماران پايينتر مي آيد.
سرپرست درمانگاه شبانهروزي بيماران هموفيلي مجتمع بيمارستاني امام خميني(ره) يادآور شد: در حال حاضر حدود 8 تا 9 هزار بيمار انعقادي در کشور وجود دارد که قسمت عمده اين افراد هموفيلي A، هموفيليB، اختلالات پلاکتي و اختلالات خونريزي نادر هستند.دکتر منقچي بيماران هموفيلي را به سه دسته شديد، متوسط و خفيف تقسيم کرد و گفت: هموفيلي نوع شديد از همان بدو تولد بيماران را درگير مي کند و به دليل اينکه 99 درصد اين بيماران پسر هستند معمولا در يک سال اول زندگي بر اثر خونريزيهاي ختنه، لثه، پوستي و غيره به پزشک مراجعه مي کنند اما هموفيلي هاي متوسط ممکن است تا سن 35 سالگي هم متوجه بيماري خود نشوند ولي توصيه ميشود فردي که در خانواده خود بيمار هموفيلي دارد به منظور اقدامات پيشگيرانه سريع تر به پزشک مراجعه کند.
موضوعات مرتبط: هماتولوژي
بسته به وضعیت بیمار و نوع دیابت او و همچنین نظر پزشک این تست چندین بار در سال تکرار میشود. پیشنهاد سازمان آمریکایی دیابت ADA به این صورت است که اگر فرد مبتلا به دیابت تیپ 1 میباشد و یا مبتلا به دیابت تیپ 2 است که از انسولین استفاده میکند 4 بار در سال و در صورت ابتلا به دیابت تیپ 2 بدون درمان با انسولین به صورت 2 بار در سال تکرار شود. افزایشی معادل ۱٪ در میزانHbA1c معادل افزایش حدود 30mg% در میزان قند خون است. به عنوان مثال میزان 6٪ از HbA1c معادل قندی حدود 135mg% و HbA1c 9٪ معادل قند خون 245 میباشد.بهترین حالت HbA1c در افراد دیابتی که بیانگر کنترل خوب قند خون میباشد حدود 6٪ میباشد.
متد اندازه گیری این Hb به روش کروماتوگرافی ستونی میباشد. در این روش بعد از لیز کردن گلبولهای قرمز به وسیله محلول مخصوص موجود در کیت و طی چندین مرحله زه کشی میزان HbA1c را محاسبه میکنند.
باید توجه داشت که در موارد هموگلوبین های غیرطبیعی مانند سیکل سل میزان هموگلوبین1 A کمتر از حد طبیعی بوده و این موضوع در نتایج تستها تاثیر گذار میباشد همچنین در آنمی های همولیتیک که لیز گلوبولی وجود دارد و در موارد خونریزیهای شدید نتایج کاذب ایجاد میگردد.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
 |
از تشخيص تا درمان
به گزارش جام جم آنلاين، فريتين نشاندهنده ميزان ذخيره آهن در بدن است. معمولا بدن از طريق مواد غذايي مختلف مانند گوشت قرمز و غذاهاي دريايي آهن مورد نيازش را تامين ميكند بنابراين ترديدي نيست كه كاهش مصرف اين گروه از مواد غذايي در برنامه غذايي روزانه افراد بتواند با پيامدهايي مانند كمبود آهن همراه باشد كه بهتبع آن ميزان ذخيره آهن در بدن نيز به ميزان قابل توجهي كاهش مييابد.
خونريزيهاي شديد بويژه در دوران قاعدگي نيز سطح فريتين خون را كاهش ميدهد. اغلب خانمها بين 20 تا 40 سالگي دچار فقر آهن ميشوند و در دوران يائسگي سطح فريتين موجود در خون آنها به حالت طبيعي باز ميگردد.
به عبارت ديگر فريتين فرم ذخيره آهن در بدن است كه حدود 30 درصد كل آهن موجود در بدن را تشكيل ميدهد.
اين پروتئين حياتي آهن را در كبد و مغز استخوان كه محل ساخت گلبولهاي خوني است ذخيره ميكند و نخستين تغيير ناشي از كاهش سطح آهن بدن در فريتين ايجاد ميشود كه اغلب در مراحل اوليه هيچ اثر و نشانهاي را به همراه ندارد.
تجويز مكمل آهن مستلزم تعيين ميزان ذخيره فريتين است، زيرا تجويز بيش از اندازه مكمل آهن موجب ناراحتي فرد بيمار ميشود.
نشانههاي كمخوني ناشي از فقر آهن بندرت پيش از اينكه سطح هموگلوبين خون به كمتر از 10 برسد نمايان ميشود اما معمولا كاهش سطح فريتين علاوه بر عوارض و نشانههاي اوليه مانند خستگي مزمن، ضعف و بيحالي، سرگيجه و سردرد با علائم ديگري نظير تنگي نفس، افزايش قدرت تحريكپذيري، وزوز گوش و درد قفسه سينه نيز همراه است.
تشخيص فقر آهن بر پايه اندازهگيري فريتين است. چنانچه مقدار فريتين خون به كمتر از 14 ميكروگرم در ليتر برسد نشانه از بين رفتن كامل ذخيره آهن در بدن است البته بايد توجه داشت كه خونريزيهاي شديد معده، پركاري تيروئيد ، ابتلا به بيماريهاي مزمن كبدي مانند هپاتيت، سؤتغذيه و ايجاد اختلال در جذب مواد غذايي در بدن نيز ميتواند منجر به كاهش سطح فريتين خون شود.
ابتلا به چنين بيماريهايي با علائم ديگري نيز همراه است. در افرادي كه مستعد ابتلا به كمخوني هستند، اهداي مكرر خون به كمخوني ناشي از فقر آهن و كاهش ذخيره آهن در بدن منجر ميشود. در خانمها در مقايسه با آقايان، جبران ذخيره آهن از دست رفته كندتر انجام ميشود.
اگر كاهش سطح فريتين با كاهش شديد هموگلوبين خون همراه باشد به اين معني است كه فرد با كمخوني جزيي مواجه شده كه در اين صورت مصرف مكملهاي آهن، بهترين راهكار براي كاهش عوارض ناشي از آن است.
اگر كاهش سطح فريتين ناگهاني باشد لازم است بيمار تحت معاينات و آزمايشات كامل قرار گيرد، چراكه ابتلا به بعضي بيماريها مانند بيماريهاي كبد، عفونتهاي شديد و همچنين بيماريهاي اتوايمني زمينهاي براي ابتلا به كمخوني و كاهش ذخيره آهن بدن است.
به هر حال بايد توجه داشت در نظر گرفتن يك برنامه غذايي مناسب كه غني از سبزيجات سبزبرگ مانند اسفناج باشد و مصرف غلات، گوشت، ماهي و مرغ سطح فريتين بدن را افزايش ميدهد. با مصرف مكملهاي غذايي حاوي آهن پس از گذشت هفت تا 10 روز وضعيت خونسازي در بدن به حالت طبيعي بازميگردد اما جبران ذخاير آهن بدن مستلزم تكميل دوره شش ماهه درمان است.
موضوعات مرتبط: هماتولوژي
علاوه بر جراحی های بای پس، از این رگها همچنین می توان برای کمک به دیالیز بیماران کلیوی و کودکان دارای دریچه های قلب معیوب استفاده کرد.
به گفته محققان، آنها می توانند طی دو ماه رگ های خونی را با بافت آنها بر روی یک دستگاه بافندگی مینیاتوری در آزمایشگاه تولید کنند.
تلاشهای پیشین برای تولید رگهای مصنوع بشر یا بر مواد مصنوعی تکیه داشته یا به تولید رگهای ضعیف منجر شده بودند.
در جراحی بای پس قلبی، از یک رگ متعلق به بخش دیگری از بدن برای انحراف خون از رگهای خونی مسدود یا تنگ استفاده می شود.
این در حالی است که بسیاری از بیماران از رگهای سالم و مناسب برای پیوند برخوردار نیستند و نمونه های مصنوعی نیز احتمال عفونی شدن دارند.
با این شیوه جدید که در نشست زیست شناسی تجربی در سان دیگو رونمایی شده، می توان امکان بروز عفونت را از بین ببرد.
این شیوه ابتدا از نمونه سلولهای پوست پشت دست فرد استفاده شده که به تولید مقادیر زیاد کولاژن محکم و منعطف پرداخته و از آن یک ورق نازک سلولی تولید می کنند. سپس این ورق به حالت لوله ای درآمده و با مواد مغذی انکوبه می شود تا لایه ها به هم جوش خورده و یک لوله توخالی را شکل دهند.
در مرحله بعدی یک لایه دیگر سلول از رگ سطحی روی این لوله آمده که بخشی از نمونه پوست اولیه بوده اند.
این محققان توانسته اند رگهای خونی تا ۲۰ سانتیمتر طول را با استفاده از سلوهای بیمار و سلولهای اهدایی تولید کنند.
استفاده از سلول های اهدایی می تواند تولید این رگ ها را در مقیاس صنعتی قرار داده که قابل ذخیره در سردخانه و مصرف در زمان نیاز خواهند بود.
رگ های بدست آمده از سلول های اهدایی تا کنون در سه بیمار با بیماری شدید کلیوی پیوند خورده که امکان دیالیز بهتر را برای آنها فراهم خواهد کرد.
تا کنون این پیوند موفقیت آمیز بوده و بیمار اول در سال گذشته درمان شد.
می توان سرعت این فرایند را با حذف مرحله لوله کردن ورق سلولی افزایش داده و به جای آن سلول ها را به شکل رشته های مناسب برش داد. سپس این رشته ها را می توان روی یک قرقره پیچیده و بر روی یک دستگاه نساجی ریز ایترسل به شکل لوله ای بافت.
انجام این کار می تواند زمان تولید یک رگ خونی را به دو ماه کاهش دهد. الیته این فرایند پر هزینه بوده و تولید هر رگ چند هزار دلار خواهد بود.
این فناوری هنوز در مراحل اولیه قرار داشته و انتظار می رود بین پنج تا ۱۰ سال آینده برای کاربرد گسترده آماده شود.
موضوعات مرتبط: هماتولوژي

موضوعات مرتبط: هماتولوژي
ادامه مطلب
این آزمایش نشان می دهد که چگونه ژن افراد از طریق عوامل محیطی مانند الکل و هورمونها تغییر می کند. این تغییرات اپیژنتیک نام دارد که در یک زن از هر پنج زن به وجود می آید و خطر ابتلا به سرطان پستان در شخص را دو برابر می کند.
دکتر جیمز فلناگان، سرپرست گروه محققان می گوید: “حدس و گمانهای زیادی وجود دارد. تحقیقهای ما نشان می دهند که ممکن است سیستم دفاعی بدن نقش مهمی درابتلا به سرطان پستان بازی کند. محیط زیست هم موثر است چرا که بر بافتهای پستان و سلولهای خون تاثر می گذارد.”
گروه تحقیقاتی دکتر فلناگان در کالج سلطنتی لندن از بیش از ۱۳۰۰ زن در سنین متفاوت، آزمایش خون گرفتند.
آزمایشها نشان میدهند که ۶۴۰ نفر از این زنان ممکن است به سرطان پستان مبتلا شوند.
این تحقیقات، رابطه قوی بین سرطان پستان و تغییرات مولکولی ژنی به نام ایتیام را نشان میدهد که در سلولهای سفید خون وجود دارند.
پژوهشگران به دنبال تغییرات در ساختار ژنتیکی بودند که به آن متیلاسیون گفته می شود.
آنها متوجه شدند زنانی که بالاترین میزان متیلاسیون را دارند دو برابر زنانی که پایین ترین میزان را دارند در معرض خطر ابتلا به سرطان پستان قرار میگیرند.
به گفته آقای فلنگان سن زنان هم در پیدا کردن شواهد مهم است.
او می گوید تغییرات ژنتیکی در زنان زیر ۶۰ سال راحتتر دیده می شود. در برخی موارد هم ۱۱ سال قبل از ابتلا این تغییرات به وجود آمده و شواهد آشکار بوده است.
دکتر فلناگان می گوید که از طریق این یافته می توان از سرطان پستان قبل از ابتلا به آن جلوگیری کرد.
او می گوید: “اگر آزمایشها نشان دهد که شخصی در معرض خطر است می توان کارهایی کرد که خطر ابتلا به سرطان پستان را کاهش دهد مانند تغییر در شیوه زندگی ، طرز غذا خوردن و حتی عملهای جراحیهایی که به جلوگیری از ابتلا به این بیماری کمک می کنند.”
دکتر فلناگان می گوید چنین آزمایشهایی می تواند جان افراد زیادی را نجات دهد.
موضوعات مرتبط: هماتولوژي
خون بندناف خونی است که پس از تولد نوزاد در جفت باقی می ماند. در زمان بارداری این خون برای ادامه حیات و سلامت وی لازم است، اما پس از تولد جفت و خون آن به عنوان یک بافت اضافی به دور انداخته می شود که حاوی سلول های زیادی است.مشاهده شده است که این خون حاوی تعداد زیادی سلول های بنیادی هستند که مزایای بسیاری نسبت به سلول های بنیادی دیگر دارند.
از جمله این مزایا این که چون هنوز این سلول ها برخوردی با محیط خارج پیدا نکرده اند، اولا آلوده نبوده و ثانیا از نظر ایمنی پاسخ های ایمنی ناخواسته کمتری را ایجاد می کنند چرا که هنوز نابالغ هستند.● چرا به این سلول ها، بنیادی گفته می شوند؟
به علت این که این سلول ها منشاء بقیه سلول های بدن هستند و دارای ۲ خاصیت بوده یکی این که می توانند یک سلول شبیه خود بسازند و دیگری هم این که توانایی تکثیر و تمایز به سلول های بالغ تر را دارند و در نهایت منبعی برای حفظ حیات انسان ها هستند که انسان با مجموعه ای از سلول ها متولد می شود که مرتب پیر شده و از بین می روند که باید منبعی برای ترمیم و جایگزینی آنها وجود داشته باشد.
سلول های بنیادی شبیه سلول های جنینی عمل می کنند و توانایی تکثیر و تمایز داشته و می توانند حالت طبیعی بدن را حفظ کنند.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
 در
يک فرد سالم همه اجزاي سلولي در خون از سلولهاي بنيادي خونساز منشا
ميگيرند. بزرگسال حدودا در هر روز صد ميليارد تا يک تريليون سلول خوني
جديد توليد ميشود تا شمار اين سلولها را در گردش خون محيطي ثابت نگه
دارد.
در
يک فرد سالم همه اجزاي سلولي در خون از سلولهاي بنيادي خونساز منشا
ميگيرند. بزرگسال حدودا در هر روز صد ميليارد تا يک تريليون سلول خوني
جديد توليد ميشود تا شمار اين سلولها را در گردش خون محيطي ثابت نگه
دارد.
سلولهاي بنيادي خونساز
به گزارش باشگاه خبرنگاران، سلولهاي خوني به سه تيره يا دودمان تقسيم ميشوند:
1- سلولهاي اريتروسيت که شامل سلولهاي قرمز حامل اکسيژن در خون ميشود. در خون محيطي معمولا ميتوان دو نوع از اين سلولها يکي رتيکولوسيتها (سلولهاي قرمز هستهدار) و اريتروسيت (سلولهاي قرمز بيهسته که اکثريت سلولهاي قرمر را تشکيل ميدهند) را ديد. در واقع شمار رتيکولوسيتها در خون بيانگر ميزان توليد سلولهاي قرمز (اريتروپوئيز) در بدن است.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
محققان دانشگاه ورمونت موفق به کشف دو پروتئین جدید در سلول های قرمز خون شده اند که می تواند وجود دو نوع جدید از گروه خونی قابل آزمایش را به اثبات برساند.
این کشف جدید از آن جهت پراهمیت است که می تواند خطر انتقال گروه های خونی ناسازگار را در میان دهها هزار انسان کاهش دهد.
اما نکته جالب توجه درباره کشف جدید این است که این
دو نوع جدید گروه خونی می تواند تعداد کلی گروه های خونی شناخته شده را به
32 برساند.
در واقع به جز گروه های A، B، AB و O گروه های خونی
دیگری نیز وجود دارند که به نسبت این چهار گروه کمیاب ترند و معمولا نام
افرادی را به خود می گیرند که در بدن آنها جاری بوده و سپس کشف شده اند.
این گروه های خونی نادر از قبیل گروه های «جونیور» یا «لانگریز» به واسطه وجود گروه های ویژه از آنتی ژنها شناسایی می شوند و بسیاری از آنها از قبیل گروه های خونی Kell و MNS با گروه های خونی A یا O همخوانی و سازگاری دارند.
اما کشف گروه های خونی جدید معمولا امری بسیار نادر است، کشف آخرین نمونه جدید گروه خونی به بیش از یک دهه پیش باز می گردد، از این رو کشف دو گروه خونی به صورت همزمان رویداد بسیار مهمی به شمار می رود.
موضوعات مرتبط: هماتولوژي
علايم شايع
پتشي (لكه هاي كوچك ، گرد، بدون برجستگي و به رنگ قرمز مايل به ارغواني در پوست )
تمايل به كبودشدگي
خونريزي در دهان
خون دماغ
قاعدگي هاي شديد يا طولاني
وجود خون در ادرار
موضوعات مرتبط: هماتولوژي
ادامه مطلب
نام آزمايش:PTT
نوع نمونه: نمونه خون از ورید بازو
علت درخواست تست:
|
اين
تست به عنوان بخشی از تحقیق درباره اختلال خونریزی احتمالي؛ برای پايش
درمان ضدانعقاد هپارین؛ هنگامی که فرد خونریزی یا لخته شدن خون بي دليل
دارد؛ هنگامی که فرد تحت درمان ضدانعقاد هپارین شکسته نشده (استاندارد)
است؛ گاهی اوقات به عنوان بخشی از پايش قبل از جراحی درخواست مي شود. PTT، تست غربالگری است که به ارزیابی توانایی فرد در تشکيل لخته هاي خون به طور مناسب كمك مي كند.PTT، زمان تشكيل لخته در لوله آزمایش (در ثانیه)، هنگامی که مواد خاص (معرفها) به نمونه پلاسما اضافه مي شوند را اندازه گیری مي كند. با اندازه گیری مدت زمان لازم برای تشکیل لخته، PTT مقدار و نيز عملكرد فاکتورهای انعقادی خاصی را که بخشی از هموستاز هستند، ارزیابی مي كند. نتایج PTT که در حدفاصل مرجع قرار می گیرند، معمولا عملکرد طبیعی لخته شدن خون را نشان می دهند، با این حال، کمبودهای خفیف تا متوسط تنها یک فاکتور انعقادی ممکن است هنوز وجود داشته باشد. PTT ممکن است تا زمانی که مقدار فاكتور به 30٪ تا 40٪ حد نرمال کاهش نیافته است، طولانی نشود. همچنین ضدانعقاد لوپوس ممکن است وجود داشته باشد اما نتیجه PTT را طولانی نكند. PTT طولانی مدت به این معنی است که تشكيل لخته بيش از حد انتظار اطول مي كشد و ممکن است ناشي از علل مختلف باشد. اغلب ممکن است کمبود فاکتور انعقادی یا مهاركننده اختصاصي یا غیراختصاصی تأثيرگذار بر توانایی لخته شدن خون بدن وجود داشته باشد. کمبود فاکتور انعقادی، ممکن است اكتسابي يا ارثي باشد. |
موضوعات مرتبط: هماتولوژي
ادامه مطلب
هموگلوبین
هموگلوبین مولکول اصلی داخل گویچههای قرمز است که از هم و زنجیرههای پروتئنی یا گلوبین تشکیل شده است. در هر زنجیره گلوبین یک مولکول هم وجود دارد که اکسیژن را توسط آهن خود حمل میکند. پس تولید هموگلوبین نیاز به به تامین آهن و ساخت هموگلوبین دارد. بر اساس نوع زنجیره پروتئینی چند نوع هموگلوبین وجود دارد:
- هموگلوبین A: هموگلوبین طبیعی در بالغین عمدتا همولگوبین A میباشد که تقریبا حدود 98% از هموگلوبین جریان خون را تشکیل میدهد و از زنجیره 4 تایی حاوی دو زنجیره آلفا و دو زنجیره بتا ساخته میشود. (α2β2)
- HGbA2: هموگلوبین A2 از 2 زنجیره آلفا و 2زنجیره دلتا تشکیل میشود.(α2δ2) که بطور طبیعی 2-1% هموگلوبین در بالغین را تشکیل میدهد.
- HGbF: هموگلوبین F که هموگلوبین اصلی دوران جنینی است و کمتر از 1% هموگلوبین در بالغین را نیز شامل میشود،از زنجیره 4 تایی 2 تا آلفا و 2 تا گاما (α2δ2) تشکیل گردیده است و هموگلوبین های C , H و ... که در بعضی بیماریها بوجود میآید.
برای ساخت زنجیره بتا هر فرد از هر والد
خود (پدر و مادر) یک ژن سازنده این زنجیره را دریافت میکند و برای زنجیرههای δ,α از
هر والد 2 ژن دریافت میکند. و بر اساس جهش یا حذف هر کدام از این ژنها ساخت و زنجیره
مربوطه مختل شده و انواع بیماری تالاسمی را خواهیم داشت.
هموگلوبین نه تنها برای حمل و تحویل
طبیعی اکسیژن لازم است، بلکه در شکل و اندازه و بدشکلی گلبول قرمز دخالت دارد.
مقدار کل هموگلوبین خون بطور طبیعی در خانمها 2±12
و در آقایان 2±14 گرم در دسیلیتر میباشد.
انواع تالاسمی
تالاسمی به دو نوع آلفا تالاسمی و بتا تالاسمی است که خود بتا
تالاسمی هم شامل تالاسمی ماژور (تالاسمی شدید) و تالاسمی مینور یا
تالاسمی خفیف میباشد. افراد مبتلا به تالاسمی مینور در واقع کم خونی مشکلسازی ندارندریا، ولی اگر دو فرد
تالاسمی مینور با هم ازدواج کنند به احتمال 25% فرزندنشان دچار تالاسمی شدید ماژور
خواهد بود و 25% فرزندشان سالم و 50% تالاسمی مینور خواهند داشت.
|
|
تالاسمی ماژور
تالاسمی ماژور یا آنمی کولی به علت حذف یا جهش در هر دو ژن سازنده زنجیره بتا ایجاد میشود و به این ترتیب یا هیچ زنجیره بتایی ساخته نمیشود و یا به مقدار کمی ساخته میشود. در نتیجه بدن کمبود این زنجیرهها را با ساخت زنجیرههای آلفا جبران میکند که این زنجیرههای آلفای اضافی برای گلبولهای قرمز سمی هستند و با رسوب بر روی سلولهای گلبول قرمز باعث میشوند که گلبولهای قرمز در مغز استخوان و در داخل خون تخریب شده و زنجیرههای آلفا در مغز استخوان رسوب میکنند. از طرفی به علت خونسازی غیر موثر ، مراکز خونساز خارج مغز استخوان ، ار جمله کبد و طحال شروع به خونسازی میکنند و بزرگ میشوندبیماری معمولا بصورت کم خونی شدید در 6 ماهه اول زندگی کودک تظاهر میکند و درصورت عدم شروع تزریق خون ، بافت مغز استخوان و مکانهای خونساز خارج مغز استخوان فعال و بزرگ شده و باعث بزرگی مغز استخوانها بخصوص استخوانهای پهن (صورت و جمجمه) و بزرگی کبد و طحال میشوند.
علایم بیماری
- کم خونی شدید طوریکه برای بقاء بیمار تزریق مکرر خون لازم است.
- افزایش حجم شدید مغز استخوان بخصوص در استخوانهای صورت و جمجمه ، چهره خاص افراد تالاسمی را ایجاد میکند (چهره موش خرمایی).
- اختلال رشد دربچههای بزرگتر
- رنگ پریدگی ، زردی و گاهی پوست ممکن است به دلیل رنگ پریدگی و یرقان و رسوب ملانین به رنگ مس در آید.
- بزرگی کبد و طحال ، در سنین بالاتر گاهی طحال به حدی بزرگ میشود که باعث تخریب بیشتر گلبولهای قرمز میشود.
- علایم ناشی از رسوب آهن در بافتهای مختلف از جمله پانکراس و قلب و غدد جنسی و ایجاد دیابت و نارسایی قلبی و تاخیر در بلوغ.
- استخوانها نازک شده و مستعد شکستگی میشوند.
- .
موضوعات مرتبط: هماتولوژي
ادامه مطلب
موضوعات مرتبط: هماتولوژي
ادامه مطلب
خون از مایع لزجی به نام پلاسما و یاخته های شناور آن که توسط مغز استخوان تولید می شود تشکیل شده است.
مغز استخوان ماده ای نرم و اسفنجی شکل است که داخل استخوانها یافت می شود. این ماده حاوی یاخته هایی است که یاخته های مادر یا سلول پایه (Stem cell) نامیده می شود و وظیفه آنها تولید یاخته های خونی است.
سه نوع یاخته خونی وجود
دارد
:
گویچه های سفید خون (گلبولهای سفید) که مسئول دفاع بدن در
مقابل عوامل خارجی هستند
گویچههای قرمز خون (گلبولهای قرمز خون) که اکسیژن را به
بافتها حمل کرده و فرآورده های زائد را از اندامها و بافتها جمع آوری می کنند
پلاکتها که وظیفه انعقاد خون و جلوگیری از خونریزی را بر
عهده دارند
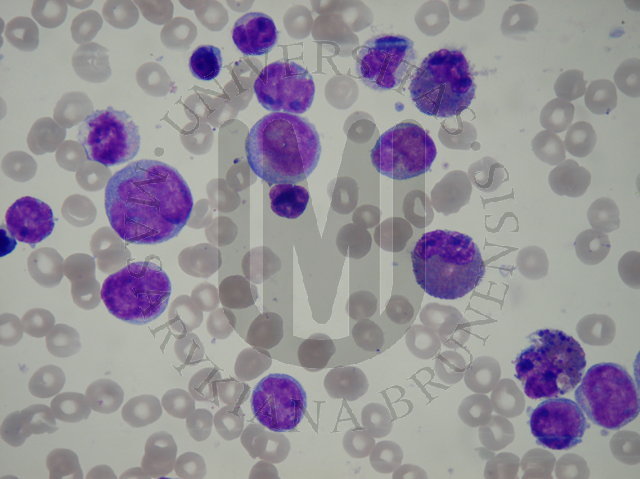
سرطان خون (لوسمی) نوعی بیماری پیشرونده و بدخیم اعضای خون ساز بدن است که با تکثیر و تکامل ناقص گویچههای سفید خون و پیش سازهای آن در خون و مغز استخوان ایجاد می شود.
لوسمی یا لوکمی leukemia ریشه در زبان لاتین به معنای “خون سفید” دارد و فرآیند تکثیر، خونسازی و ایمنی طبیعی بدن را مختل می کند. اجتماع این یاخته های سرطانی در خارج از مغز استخوان، موجب تشکیل توده هایی در اندامهای حیاتی بدن نظیر مغز و یا بزرگ شدن غده های لنفاوی، طحال، کبد و ناهنجاری عملکرد اندامهای حیاتی بدن می شوند.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
لوسمی
لوسمی حاد چیست ؟
لوسمی سرطانی است که در مغز استخوان ( قسمت داخلی نرم استخوان ها ) شروع می شود و سریعا به داخل خون می رود و می تواند به نقاط دیگر بدن مانند گره های لنفاوی ، کبد ، طحال ، سیستم عصبی مرکزی ( مغز و طناب نخاعی ) و بیضه ها گسترش یابد .
حاد بدین معنی است که لوسمی سریع گسترش می یابد و اگر درمان نیابد در طی چند ماه احتمال مرگ وجود دارد .
مغز استخوان و بافت لنفوئید
مغز استخوان قسمت داخلی نرم بعضی از استخوان ها مانند جمجمه ، شانه ، دنده ها ، لگن و استخوان های پشت می باشد که از سلول های هماتوپونتیک ( تشکیل دهنده خون ) ، سلول های چربی و بافت های حمایتی که به رشد سلول های هماتوپونتیک کمک می کند تشکیل می شود ؛ این ها شامل سلول های اصلی هماتوپونتیک که به طور مرتب سلول های جدید را ایجاد می کنند می شود ، بعضی از این سلول های جدید به عنوان سلول های اصلی باقی می مانند تا زمانی که بقیه سلول ها دست خوش یک سری تغییرات شوند . به هنگام این مراحل سازندگی سلول های اصلی هماتوپونتیک متوقف می شود و سرانجام یکی از سه نوع سلول خونی ، سلول های قرمز خون ، سلول های سفید خون یا پلاکت ها را ایجاد می کنند .
سلول های قرمز خون حاوی هموگلوبین هستند که اکسیژن را از ریه ها به بافت های دیگر بدن حمل می کنند و دی اکسید کربن را به ریه ها بر می گردانند . کم خونی ( کاهش تعداد سلول های قرمز خون ) به طور مشخص باعث ضعف ، خستگی و کوتاهی نفس می شود .
معمولا پلاکت ها به عنوان نوعی سلول خونی طبقه بندی می شوند اما در واقع پلاکت ها در ترمیم نواحی آسیب دیده رگ های خونی به علت بریدگی یا کبودی با اهمیت می باشند . کاهش تعداد پلاکت ها را ترومبوسیتوپنی می نامند که در صورت صدمه رگ های خونی موجب افزایش خونریزی می شود .
سلول های سفید خونی که لکوسیت نامیده می شوند در دفاع بدن در مقابل ویروس ها و باکتری ها بااهمیت هستند . دو نوع اصلی سلول های سفید لنفوسیت ها و گرانولوسیت ها هستند . در گروه گرانولوسیت ها چندین نوع متفاوت سلول وجود دارند که به عنوان گروه میلوئید نامیده می شوند و شامل نوتروفیل ، ائوزینوفیل و بازوفیل هستند . سلول دیگر منوسیت می باشد که تقریبا مشابه با انواع دیگر است .
گرانولوسیت ها گروهی از سلول های سفید خونی هستند که وظیفه اصلی آن ها انهدام باکتری هاست با توجه به رنگ و اندازه گرانول ها ، سه نوع گرانولیست نوتروفیل ، بازوفیل و ائوزینوفیل را می توان تشخیص داد ( نقاطی در داخل سلول ها که زیر میکروسکوب دیده می شوند ) . این گرانول ها حاوی آنزیم ها و دیگر موادی هستند که موجب تخریب باکتری هایی که عفونت را به وجود می آورند می شوند . گرانولوسیت ها در حین دوره تکامل چندین تغییر را می گذرانند در واقع آن ها از میلوبلاست نابالغ تبدیل به سلول های بالغ مهاجم در برابر عفونت می شوند .
منوسیت ها هم در محافظت بدن در مقابل باکتری ها نقش مهمی را به عهده دارند . در ابتدا آن ها در مغز استخوان به صورت منوبلاست نابالغ می باشند و بعد از بلوغ منوسیت ها را تشکیل می دهند . در طول یک روز گسترش خون در بدن ، منوسیت ها داخل بافت ها می شوند تا ماکروفاژها را ایجاد کنند . آن ها بعضی از باکتری ها را با احاطه کردن و بلعیدن از بین می برند . ماکروفاژها به لنفوسیت ها در تشخیص میکروب ها و تولید آنتی بادی جهت مقابله با میکروب ها کمک می کنند .
بافت لنفوئیدی که بافت لنفاتیک هم نامیده می شوند قسمت اصلی سیستم ایمنی است که از چندین نوع متفاوت سلولی که با عفونت ها مقابله می کنند تشکیل می شوند . هم چنین بافت لنفوئید نقش دفاعی در برابر بعضی از انواع سرطان دارند . این بافت در گروه لنفاوی ، تیموس ، طحال ، لوزه ها ، مغز استخوان و به صورت پراکنده در سیستم دستگاه گوارش و تنفس وجود دارد . سلول اصلی بافت لنفوئید لنفوسیت ها هستند که شامل دو نوع سلول B و سلول T می باشد .
سلول های B با تغییر به سلول های پلاسما از تهاجم باکتری ها به بدن جلوگیری می کنند و آنتی بادی ها را تولید می کنند این آنتی بادی ها به میکروب های مهاجم می چسبند . در نتیجه گرانولوسیت ها و ماکروفاژها قادر به شناسایی میکروب ها و انهدام آن ها می شوند . سلول های T سلول های عفونی شده توسط ویروس ها را تشخیص داده در انهدام آن ها توسط ماکروفاژها کمک می کند .
هر سلول لنفوئید یا هماتوپونتیک که در مغز استخوان تشکیل می شود می تواند به سلول سرطانی ( لوسمیک ) تبدیل شود . اگر این اتفاق روی دهد اولین سلول سرطانی تقسیم می شود و تعداد زیادی سلول سرطانی ایجاد می کند و سرانجام این سلول ها سراسر مغز استخوان را می پوشانند و به داخل گردش خون نفوذ کرده در اعضاء دیگر بدن پخش می شوند .
انواع لوسمی
لوسمی ها به چهار گروه اصلی با زیر گروه های متفاوت تقسیم می شوند تا پیش بینی پیش آگهی هر بیمار آسان تر صورت گیرد و به پزشک در تقسیم بهترین درمان برای هر بیمار کمک شود .
لوسمی حاد در مقابل لوسمی مزمن : اولین عامل برای تقسیم بندی یک بیمار لوسمیک این است که مشخص شود سلول های غیر طبیعی بالغ هستند ( مشابه سلول های سفید خون در گردش خون نرمال ) یا نابالغ.
در لوسمی حاد ، سلول های مغز استخوان بلوغ مناسبی ندارند . سلول های لوسمیک نابالغ اغلب بلاست نامیده می شوند . به تولید مثل و تجمع ادامه می دهند .
در لوسمی مزمن سلول ها بالغ می شوند . هر چند سلول های لوسمی مزمن به نظر بالغ هستند اما کاملا طبیعی نیستند و نمی توانند مانند سلول های سفید خون با عفونت ها مقابله کنند .
لوسمی میلوژن در برابر لوسمی لنفوسیتیک :
فاکتور دومی که در طبقه بندی لوسمی ها در نظر گرفته می شود نوع سلول های مغز استخوان است . اگر گرانولوسیت ها یا منوسیت ها درگیر باشند لوسمی میلوژن نامیده می شود .
اگر سرطان لنفوسیت های مغز استخوان را درگیر کند لوسمی لنفوسیتیک نامیده می شود . لنفوم بدخیم نوعی سرطان لنفوسیتیک است اما بر خلاف لوسمی لنفوسیتیک که مغز استخوان را درگیر می کند لنفوما لنفوسیت های گره های لنفی و اعضای بدن را درگیر می کند .
چهار نوع اصلی لوسمی :
· لوسمی حاد میلوژن (AML )
· لوسمی مزمن میلوژن (CML )
· لوسمی حادلنفوستیک (ALL )
· لوسمی مزمن لنفوستیک (CLL )
نکات آماری در مورد لوسمی حاد بزرگسالان :
در طول سال 2002 ، حدود 30800 مورد جدید لوسمی در آمریکا تشخیص داده شد . تقریبا نیمی از این موارد لوسمی حاد بودند شایع ترین نوع لوسمی بزرگسالان ، لوسمی حاد میلوژن می باشد که حدود 10600 مورد بوده است .
در حدود 8800 مورد مرگ در نتیجه لوسمی حاد درسال 2002 در امریکا اتفاق افتاد .
متوسط سن برای ابتلا به لوسمی حاد میلوژن (AML ) 65 سال می باشد .
لوسمی حاد لنوستیک (ALL ) در میان اطفال شایع تر است . سن کودکان مبتلا بهبیماری معمولا کمتر از 10 سال است . سفید پوستان دو برابر نژاد آمریکایی – آفریقایی به ALL مبتلا می شوند .
عوامل خطر برای لوسمی حاد بزرگسالان :
عوامل خطر ، عواملی هستند که احتمال ابتلا فرد به سرطان راافزایش می دهد این عوامل با شیوه زندگی محیط و ژنتیک ( وراثت) در ارتباط است .
عوامل خطر مرتبط با نحوه زندگی در انواع سرطان ها شامل سیگار یا نورشدید خورشید می باشد . تنها عامل مرتبط به شیوه زندگی که جزء عوامل خطر ثابت شده لوسمی است سیگاراست .
عوامل محیطی ، عواملی هستند مانند رادیاسیون ، مواد شیمیایی و عفونت ها که در محیط اطراف ما قرار دارند . در محیط کار در معرض بنزن ( یک نوع ماده شیمیایی ) بودن به مقدار زیاد به مدت طولانی از عوامل خطر AML به حساب می آید . رادیاسیون به مقدار زیاد ( بازماندگان بمب اتمی یا حوادث راکتورهای هسته ای ) بیش از دیگران در معرض AML یا ALL قرار دارند .
بیمارانی که نوع دیگری سرطان دارند و با داروهای شیمی درمانی خاصی درمان می شوند بیشتر درگیر AML می گردند . داروهایی که اغلب همراه با لوسمی ثانویه ( بعد از درمان ) هستند شامل مکلروتامین ، پروکاربازین ، کلرامبوسیل ، اتوپوساید ، تنیپوساید و به میزان کمتر سیکلوفسفاماید می باشد . ترکیب این داروها با رادیو تراپی میزان خطر را افزایش می دهد . اکثر لوسمی های ثانویه AML هستند و در طول 9سال بعد از درمان بیماری هوچکین ، لنفوم نان هوچکین یا ALL اطفال اتفاق می افتند .
در بیماران مبتلا به بیماری های نادری مانند کم خونی فانکونی ، سندرم وسیکویت آیدریچ ، سندرم بلوم ، سندرم لی فرامنی یا آتاکس تلالژکتاری احتمال ابتلا به لوسمی حاد بسیار زیاد است .
لوسمی حاد بزرگسالان چگونه تشخیص داده می شود ؟
علایم و نشانه های لوسمی حاد
غلب علایم و نشانه های لوسمی حاد به علت کاهش تعداد گلبول های خونی نرمال و هم چنین به علت کاهش تراکم سازنده های سلول های خونی در مغز استخوان ایجاد می شوند و در نتیجه فرد از عملکرد مناسب گلبول های قرمز خون ، گلبول های سفید و پلاکت ها برخوردار نیست .
آنمی یا کاهش گلبول های قرمز خون موجب کوتاهی تنفس ، خستگی و زودرس و ( رنگ پریدگی ) پوست می شود .
کاهش تعداد گلبول های سفید خون ( لکوپنی ) خصوصا کاهش گرانولوسیت های بالغ ( نوتروپنی یا گرانولوسیتوپنی ) خطر ابتلا به عفونت را افزایش می دهد .
ترومبوسیتوپنی ( کاهش تعداد پلاکت های خون که برای فرآیند انعقاد خون در رگ های آسیب دیده لازم است ) موجب کبودی ، خونریزی ، خونریزی بینی مکرر و شدید و خونریزی از لثه ها می شود .
با گسترش سلول های لوسمی به خارج از مغز استخوان ( گسترش اکسترامدولدی ) ، سیستم عصبی مرکزی ( مغز و نخاع ) ، بیضه ها ، تخمدان ها ، کلیه ها و دیگر اعضاء بدن درگیر می شوند . علائم سیستم عصبی مرکزی لوسمی عبارتند از : سردرد ، ضعف ، تشنج ، تهوع ، اختلالات تعادل ، تاری دید . بعضی از بیماران با دردهای استخوانی یا درد مفاصل به پزشک مراجعه می کنند که در این گروه بیماری ، به علت گسترش سلول های لوسمی در استخوان یا به داخل مفاصل است .
غالبا در نتیجه لوسمی کبد و طحال که در دوطرف راست و چپ شکم قرار دارند بزرگ می شوند و بزرگی این دو عضو منجر به احساس پری و برآمدگی در حفره شکم می شود .
تورم گره های لنفی داخل قفسه سینه یا شکم هم ممکن است ایجاد شود ، اما فقط با انجام CT اسکن یا MRI قابل تشخیص است .
در لوسمی میلوژنیک حاد (AML) خصوصا در نوع M5 یا منوستیک ، درگیری لثه ها را هم خواهیم داشت که موجب تورم ، درد و خونریزی لثه ها می شود . درگیری پوست موجب ایجادتجمعات رنگی کوچکی به صورت دانه های رنگی می شود . تجمع غده ای سلول های AML در زیر پوست یا دیگر نقاط بدن کلروما یا سارکوم گرانولوستیک نامیده می شود .
غالبا نوع سلول T لوسمی لنفوستیک حاد (ALL) موجب درگیری تیموس می شود . بزرگ شدگی تیموس بر روی نای ( تراشه ) فشار می آورد و موجب سرفه ، کوتاهی تنفس و حتی خفگی می شود .
رشد سلول های لوسمی می تواند موجب فشار بر روی SVC و تورم سر و بازوها شده و سندرم SVC را ایجاد کند . در این صورت بیماری می تواند زندگی افراد را تهدید کند .
نمونه گیری هایی که برای تشخیص و ارزیابی لوسمی استفاده می شوند .
شمارش گلبول های خون
آزمون های مغز استخوان
در آسپیراسیون از مغز استخوان یک سوزن نازک و یک سرنگ برای برداشت مقدار اندکی از مایع مغز استخوان ( حدود یک قاشق چایخوری ) استفاده می شود .
آزمون های بیوشیمی خون :
در بیماران با تشخیص قبلی لوسمی این آزمون ها برای تشخیص درگیری کبد با کلیه به علت گسترش لوسمی یا عوارض ناشی از داروهای شیمیایی انجام می گیرد .
بیوپسی خارجی گره لنفی
پونکسیون کمری
آزمون های آزمایشگاهی برای تشخیص و طبقه بندی لوسمی
شیمی سلولی : بعد از نمونه برداری سلول های به روی ورقه های میکروسکوپی شیشه ای به نام اسلاید قرار گرفته و در معرض رنگ های شیمیایی ( دای ) قرار داده می شوند تا این رنگ را جذب و یا منعکس کنند . به عنوان مثال یک رنگ شیمیایی موجب می شود که گرانول های اکثر سلول های AML به صورت نقاط سیاهرنگی در زیر میکروسکوپ دیده شوند اما در سلول های ALL تغییر رنگی ایجاد نمی کند.
فلوسیتومتری : از این تکنیک برای بررسی سلول های مغز استخوان ، گره های لنفاوی و نمونه های خون استفاده می شود . این روش برای تعیین نوع لوسمی بسیار دقیق است . یک نمونه سلولی که با آنتی بادی های خاصی درمان شده است از مقابل دسته نور لیزر عبور داده می شود هر آنتی بادی به نوع خاصی از سلول های لوسمیک متصل می شود . اگر در نمونه مورد نظر این سلول ها وجود داشته باشند لیزر سبب خواهد شد که از این سلول ها نوری منعکس شود که توسط یک کامپیوتر اندازه گیری و تجزیه می شود . گروه هایی از سلول ها توسط این روش می توانند جدا شده و شمارش شوند .
ایمونوسیتوشیمی : مانند روش فلوسیتومتری سلول هایی که از آسپیراسیون با بیوپسی مغز استخوان به دست می آیند توسط آنتی بادی هایی اختصاصی درمان می شوند ، اما به جای لیزر و کامپیوتر برای تجزیه ، نمونه های درمان شده دچار تغییر رنگ های خاصی خواهند شد که در زیر میکروسکوپ قابل دیدن است .
ژنتیک سلولی :
مطالعات ژنتیک مولکولی : مواد اختصاصی به نام های گرنده های آنتی ژنی بر روی سطح لنوسیت ها وجود دارند .
سلول های لنفوئید طبیعی تعداد زیادی از گیرنده های آنتی ژنی متفاوت را دارند که در پاسخ بدن به انواع بسیاری از عفونت ها کمک می کنند .
لوسمی لنفوستیک مانند ALL از یک سلول غیر طبیعی لنفوسیت شروع می شود بنابراین همه سلول ها در بیمار لوسمیک گیرنده آنتی ژنی مشابهی دارند .
مطالعات تصویری :
اشعه X
CT اسکن
اسکن گالیوم و استخوان
سونوگرافی
MRI
عوامل پیش آگهی کننده AML حاد
زیر گروه M3 یا M4 بهترین پیش آگهی را دارند .
بعضی از تغییرات کروموزومی مانند ترانسلوکاسیون ( 17و 15) معکوس شدن (16) و ترانسلوکاسیون (21و8) پیش آگهی بهتری دارند .
تغییرات کروموزمی دیگر مانند ترانسلوکاسیون (11و9) و اضافه شدن (8) و اختلالات کروموزمی 5 یا 7 پیش آگهی بدتری دارند .
بیماران جوان تر از 55 سال پیش آگهی بهتری دارند .
شمارش گلبول سفید اولیه کمتر از 100000پیش آگهی بهتری دارند .
شرایط پره لوسمیک اولیه و یا لوسمی ثانویه که بعد از درمان سرطان دیگری ایجاد می شود پیش آگهی بدتری دارد .
عوامل پیش آگهی کننده ALL بزرگسالان
بیماران جوان تر پیش آگهی بهتری دارند .
شمارش گلبول های سفید اولیه کمتر از 50000پیش آگهی بهتری دارند .
شکل L3، FAB پیش آگهی بدتری دارند .
تغییر کروموزمی به نام کروموزوم فیلادلفیا ، ترانسلوکاسیون (22و9) پیش آگهی بدتری دارند .
ALL سلول T بهترین پیش آگهی را دارد . ALL سلول B بالغ بدترین و ALL سلول پره B پیش آگهی متوسط دارد .
بیمارانی که بیش از 4-5 هفته درمان به رمیسیون کامل می رسند پیش آگهی بدتری دارند .
ندرتا برای تشخیص لوسمی از جراحی استفاده می شود چون اسپیراسیون مغز استخوان معمولا برای تشخیص و طبقه بندی لوسمی به کار می رود .
رادیوتراپی :
گاهی اوقات رادیوتراپی برای درمان سلول های لوسمیک در مغز و مایع نخاعی و یا بیضه ها استفاده می شود . البته به ندرت به طور اورژانس برای درمان فشار بر روی نای هم استفاده می شود حتی در این شرایط هم شیمی درمانی جایگزین رادیوتراپی می شود .
شیمی درمانی :
به طور کلی در درمان AML از دوزهای بالاتری از شیمی درمانی در مدت زمان کوتاه تری استفاده خواهد شد و در ALL دوره های کمتر شیمی درمانی در دوره طولانی تری مورد استفاده قرار می گیرد .
از آن جایی که درمان بیماران لوسمیک در بیمارستان انجام می شود می توان با دستورات زیر میزان عفونت را کاهش داد :
· تمام افرادی که با بیمار تماس دارند باید دست های خود را بشویند .
· پوشیدن گان و ماسک هم مفید است .
· میوه جات و سبزیجات خام مصرف نشوند ، چون دارای باکتری هستند .
· هیچ گل و گیاهی در اتاق نباشد ، چون آن ها هم ممکن است با خود باکتری داشته باشند .
· محیط اتاق سرد نباشد .
سندرم لیزر تومور عارضه ای از شیمی درمانی است که در نتیجه تخریب سریع سلول های لوسمی ایجاد می شود .
این شرایط با دریافت مایعات فراوان و داروهای خاص مانند بی کربنات و آلوپورینول که به بدن در دفع این مواد کمک می کند جلوگیری می شود .
یکی از عوارض بسیار وخیم شیمی درمانی ALL درگیری احتمالی با لوسمی ثانویه ، AML می باشد . در موارد کمتر شایع ، بیمار لوسمیک درمان می شود اما مدتی بعد دچار لنفوم نان هوچکین و یا دیگر سرطان ها خواهد شد .
درمان AML
درمان AML به دو بخش تقسیم می شود ؛ القارمیسیون و درمان پس از رمیسیون ( تکنسین موقتی ) .
موضوعات مرتبط: هماتولوژي
ادامه مطلب
لوسمی میلوئید حاد (AML(Acute myeloid leukemia بصورت نامیرا سلولهای پروژنیتور میلوئید نابالغ را درگیر کرده و یک بیماری هتروژن است. مطالعات بالینی AML را بر طبق ناهنجاریهای سایتوژنتیک به سه طبقه Low ,Intermediate ,High-risk طبقه بندی می کنند. زیر گروه Low-risk در AML لوسمی پرومیلوسیتیک حاد (APL) است. تقریبا 98% از بیماران با APL دارای translocation کروموزوم 15 و17 هستند که منجر به فیوژن( RARα(Retinoic acid receptor α که کد کننده گیرنده رتینوئیک اسید می باشد، با پروتئین( PML(promyelocytic leukemia می شود. این بیماران با All-trans retinoic acid در ترکیب با شیمی درمانی درمان می شوند. و این درمان منجر به بهبودی طولانی مدت در این بیماران می گردد. بیمارانی که عود داشته باشند بطور موفقیت آمیزی با آرسنیک تری اکساید درمان می شوند. مدل های کشت سلولی نشان می دهند که پروتئین فیوژن PML-RARα و همچنین بطور نادرتر (t(11,17 درهمراهی با پروتئین فیوژن PLZF(promyelocytic leukemia zinc finger)-RARα مهارکننده تمایز رده های سلولهای رده میلوئید می باشد. این ممانعت ناشی از بکارگیری نابجای فاکتورهای رونویسی و آنزیم های تعدیل کننده هیستونها در ژن های نرمال تنظیم شده با گیرنده اسید رتینوئیک می باشد.(fig.1) تعدادی از ژن ها کد کننده فاکتورهای رونویسی هستند که سبب تحریک توسعه میلوئید و تنظیم سیکل سلولی می شود. همچنین PML-RARα فعال کننده ژن های تحریک کننده خود تجدید شوندگی Self-renewal و نامیرایی سلولهای لوسمی چون اعضاء مسیرهای سیگنالینگ Wnt وNotch می شود. توانایی PML-RARα برای تقویت خود تجدید شوندگی و مهار تمایز می تواند مهار شود. توسعه لوسمی در موش های ترانس ژنیک بیان کننده PML-RARα پس از یک دوره Latent حدود یک سال است. قبلا تنها توسعه intermedia از اجزاء میلوئید ذکر شده بود و پرومیلوسیت های PML-RARα پروفایل بیان ژنی مشابه و تقریبا یکسان پرومیلوسیت ها داشتند. آسیب های ناشناخته در مشارکت با PML-RARα سبب مهار تمایز و تحریک تجمع پرومیلوسیت های بدخیم و خود تجدید شونده می شود.کاربرد all-trans retinoic acid در سلولهای رده کشت APL و سلولهای طراحی شده بیان کننده پروتئین PML-RARα و موش های ترانس ژنیک بیان کننده PML_RARα سبب شروع تمایز پرومیلوسیت های بدخیم به گرانولوسیت های بالغ می شود.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
گلبول های قرمز و سفید خون
آزمایش کامل خون، همان آزمایش معروفی است که تعداد سلولهای اصلی خون طی آن اندازهگیری میشود.
complete blood countيا CBC آزمایش خون یا
به معنای «شمارش کامل خون» ، یکی از ابتداییترین و در عین حال اصلیترین آزمایشاتی است که میتواند زمینه تشخیص بسیاری از بیماریها را فراهم آورد و از همه مهم تر، بیانگر شرایط کلی و حیاتی بدن است.
RBC(RED BLOOD CELL)
مخفف سلول قرمز خون است. این سلولهای قرمز خون یا همان گلبولهای قرمز، در واقع اصلیترین قسمت خون و عامل رنگ قرمز آن هستند. خود این رنگ قرمز به دلیل وجود مادهای به نام هموگلوبین است که به گلبول قرمز کمک میکند تا اصلیترین وظیفه خود یعنی حمل و نقل اکسیژن و دیاکسیدکربن را انجام دهد. به طور خلاصه، گلبولهای قرمز، اکسیژن را از ریه به بقیه سلولهای بدن حمل می کنند.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
لوسمي ها به چهار گروه اصلي با زير گروه هاي متفاوت تقسيم مي شوند تا پيش بيني پيش آگهي هر بيمار آسان تر صورت گيرد و به پزشک در تقسيم بهترين درمان براي هر بيمار کمک شود .
لوسمي حاد در مقابل لوسمي مزمن : اولين عامل براي تقسيم بندي يک بيمار لوسميک اين است که مشخص شود سلول هاي غير طبيعي بالغ هستند ( مشابه سلول هاي سفيد خون در گردش خون نرمال ) يا نابالغ.
در لوسمي حاد ، سلول هاي مغز استخوان بلوغ مناسبي ندارند . سلول هاي لوسميک نابالغ اغلب بلاست ناميده مي شوند . به توليد مثل و تجمع ادامه مي دهند .
در لوسمي مزمن سلول ها بالغ مي شوند . هر چند سلول هاي لوسمي مزمن به نظر بالغ هستند اما کاملا طبيعي نيستند و نمي توانند مانند سلول هاي سفيد خون با عفونت ها مقابله کنند .
لوسمي ميلوژن در برابر لوسمي لنفوسيتيک :
فاکتور دومي که در طبقه بندي لوسمي ها در نظر گرفته مي شود نوع سلول هاي مغز استخوان است . اگر گرانولوسيت ها يا منوسيت ها درگير باشند لوسمي ميلوژن ناميده مي شود .
اگر سرطان لنفوسيت هاي مغز استخوان را درگير کند لوسمي لنفوسيتيک ناميده مي شود . لنفوم بدخيم نوعي سرطان لنفوسيتيک است اما بر خلاف لوسمي لنفوسيتيک که مغز استخوان را درگير مي کند لنفوما لنفوسيت هاي گره هاي لنفي و اعضاي بدن را درگير مي کند .
چهار نوع اصلي لوسمي :
· لوسمي حاد ميلوژن (AML )
· لوسمي مزمن ميلوژن (CML )
· لوسمي حادلنفوستيک (ALL )
· لوسمي مزمن لنفوستيک (CLL )
علائم هشدار دهنده سرطان خون (لوسمی)
-
احساس ناخوشی عمومی
-
تظاهر لکههای دانه اناری زيرجلدی پوست (petechiae)
-
لخته يا منعقد نشدن خون در پی ايجاد زخم يا بريدگی
-
ضعف و خستگی مفرط
-
عفونتهای مکرر و عود آنها
-
دردهای استخوان و مفاصل
-
تنگی نفس در اثر فعاليت
-
تب و لرز و نشانه های شبه سرماخوردگی
-
رنگ پريدگی پيشرونده
-
تورم و بزرگی حجم غده های لنفادی، طحال و کبد
-
احساس سيری و بیاشتهائی
-
کم خونی
بررسی های تشخيص لوسمی ممکن است شامل:
آزمايش خون: در شرايط طبيعی گويچه های سفيد بالغ در خون محيطی peripheral يافت میشوند ولی زمانی که گويچههای سفيد نارس که بايد در مغز استخوان باشند به مقدار زيادی وارد خون محيطی می شوند عمدتا می تواند نشانه سرطانهای خون (لوسمی) باشد. آزمايش خون و شمارش و بررسی ياخته های شناور خون اولين گام جهت تشخيص لوسمی است.
نمونه برداری يا بيوپسی biopsy مغز استخوان: بررسی ميکروسکوپی از نمونه بافت سرطان بسيار مهم است زيرا مطمئن ترين روش برای تشخيص لوسمی و نوع آن به حساب می آيد. نمونه برداری از مايع مغز نخاع و نمونه برداری از غدد لنفاوی نيز از روش های تشخيصی سرطان خون است.
سازگاری بافتی Tissue matching: ياخته ها دارای انواع پروتئين های مختلف بر روی سطح خود هستند که از اين پروتئين ها در آزمايش های ويژه خون برای تشخيص سازگاری بافتی استفاده می شود. موفقيت در پيوند مغز استخوان به تشابه و سازگاری مغز استخوان فرد دهنده با مغز استخوان فرد گيرنده بستگی دارد که از طريق اين آزمايش سنجيده می شود.
بررسی کروموزومی cytogenic analysis: از ديگر اقدامات تشخيص ژنتيکی در افتراق انواع لوسمی است.
عکسبرداری از قفسه سينه با تابش اشعه X - تشخيص طيف پراکندگی ياخته های مهاجم و غده های لنفاوی متورم در ناحيه قفسه سينه است.
سی تی اسکن Computerised tomography scan. در اين روش دستگاه سی تی اسکن با گرفتن تعدادی عکس توسط اشعه ايکس، تصويری سه بعدی از بدن را نشان می دهد و از اين طريق پراکندگی سرطان به بخش های ديگر بدن مشخص می شود.
پرتونگاری با استفاده از تشديد ميدان مغناطيسی MRI Scan. اين آزمايش مشابه سی تی اسکن است با اين تفاوت که به جای تابش اشعه X از مغناطيس جهت عکسبرداری از اعضای بدن استفاده می شود. در اين آزمايش بيمار به مدت ۳۰ دقيقه به طور ساکن درون اتاقک اين دستگاه می ماند و تصاوير مقطعی از بدن او تهيه می شود.
سونوگرافی Ultrasound در اين شيوه از امواج صوتی جهت بررسی ساختار اندامها استفاده می شود.۹- معاينات بالينی: بررسی وضعيت غدد لنفاوی، طحال، کبد و ديگر اعضای بدن است.
موضوعات مرتبط: هماتولوژي
عناصرمتشکله خون:
1. اریتروسیت ها:سلول های قرمز خون ، سلول های دیسک مانند، پهن و مقعر الطرفین هستند.شکل منحصربه فرد این سلول ها با عمل انتقال اکسیژن ارتباط داشته ، به این ترتیب مساحت افزایش یافته ای را فراهم می سازد که از طریق آن گازهای تنفسی می توانند انتشار یابد.
اریتروسیت ها فاقد هسته و میتوکندری هستند و انرژی شان را از طریق تنفس غیر هوازیکسب می کنند و عمر آنها حدود 120 روز می باشد.
هر اریتروسیت حاوی مولکول هموگلوبین است که رنگ قرمزی به خون می بخشد. هر مولکول هموگلوبین از یک بخش پر.تئینی به نام گلوبین و رنگدانه ای حاوی آهن به نم هم ترکیب شده است.
2. لکوسیت ها: سلول های سفید خون حاوی هسته ومیتوکندری بوده ، می توانند به روش آمیبی کنند (اریتروسیت ها به طور مستقل قادر به حرکت نیستد.) لکوسیت ها به علت داشتن حرکت آمیبی می توانند با فشار از منافذ دیواره مویرگ ها عبور کرده به طرف کانون های عفونی بدن حرکت کنند، در حالی که اریتروسیت ها معمولا داخل عروق خونی محبوس می مانند. حرکت لکوسیت ها از طریق دیواره های مویرگی "دیاپدز" خوانده می شود.
در حالت معمول لکوسیتها در زیر میکروسکوپ تقریبا نامرئی بوده ، مگر اینکه رنگ آمیزی شوند. لکوسیت ها طبق اختصاصات رنگ پذیزی یشان طبقه بندی میشود. لکوسیت های که در سیتوپلاسم خود حاوی گرانول اند، لکوسیت دانه دار و آن هایی که فاقد دانه اند،لکوسیت بدون دانه ( آگرانول )خوانده می شود.
رنگی که برای مشاهده سلول سفید خون به کار می رود، معمولا مخلوطی از رنگ صورتی مایل به قرمز به نام ائوزین و نوعی رنگ آبی مایل به ارغوانی به نام رنگ قلیایی است. از این رو ، لکوسیت های دانه دار دارای رنگ آبی مایل به ارغوانی بازوفیل ها خوانده میشود.و همچنین لکوسیت های دانه دار مایل به قرمز ائوزینوفیل خوانده میشود.و لکوسیت هایی که میل به ترکیبی شیمیایی اندکی به هر دو رنگ دارند، نوتروفیل ها خوانده میشوند.
نوتروفیل ها فراوان ترین نوع لکوسیت هاهستند ودارای هسته 2-5 قسمتی ، و گرانول های سیتوپلاسمی به رنگ بنفش روشن هستند. ائوزینوفیل ها دارای هسته دو قسمتی با گرانول های سیتوپلاسمی با رنگ ائوزینوفیل قرمز هستند وهمچنین بازوفیل ها دارای هسته ای چند قطعه ای و با رنگ هماتوکسیلن آبی هستند.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
مقدمه
در اسکلت آدمی سه نوع استخوان ، پهن و کوتاه و دراز وجود دارد. هر سه نوع استخوان از بافت استخوانی درست شدهاند و پردهای به نام ضریع آنها را میپوشاند. بافت استخوانی از سلولها و بخش زمینهای که بین سلولها را پر میکند درست شده است. بافت استخوانی به دو صورت بافت متراکم و اسفنجی وجود دارد. بافت استخوانی متراکم مانند تنه استخوانهای دراز از مجموعههایی به نام سیستم هاورس درست شده است.در هر سیستم هاورس یک مجرا و تیغههای استخوانی متحدالمرکز وجود دارد. در مجرای هاورس رگهای خونی و اعصاب وجود دارند. در بافت اسفنجی تیغههای نامنظم استخوانی دیده میشود که در حفرههای وسط آنها مغز استخوان و رگهای خونی قرار دارند. ضریع پردهای است پیوندی ، مرکب از دو لایه و همین لایه ضریع است که رشد قطری استخوان را سبب میشود.
انواع مغز استخوان
مغز استخوان بافت نرم و پرعروقی است که داربست آن را بافت رتیکولر تشکیل میدهد و بر روی آن سلولهای مختلف خونی ، خونساز و چربی قرار دارد. مغز استخوان حفره مرکزی استخوانهای دراز و فضاهای بین ترابکولی استخوانهای اسفنجی را پر میکند. مغز استخوان به دو صورت مغز قرمز و مغز زرد دیده میشود که اولی عمدتا از سلولهای خونساز تشکیل شده و بافت میلوئید نیز خوانده میشود و دومی عمدتا حاوی سلولهای چربی است.در مرحله جنینی و پس از تولد تا مرحله بلوغ همه استخوانها حاوی مغز قرمز میباشند ولی در بزرگسالان مغز قرمز محدود به مهرهها ، استخوانهای جناغ ، دندهها و استخوانهای جمجمه میباشد و در بقیه جاها با مغز زرد جایگزین میشود.

|
موضوعات مرتبط: هماتولوژي
ادامه مطلب
مقدمه
استخوان یکی از سختترین انواع بافت پیوندی است. سختی آن بیشتر به یک ماده پلاستیکی شباهت دارد تا به یک سنگ. زیرا کاهش کلسیم آن را نرم میکند و کاتیونهایی نظیر سرب ، استرانسیم و رادیم جانشین کلسیم میشوند و سختی استخوان را از بین میبرند. استخوان نظیر دیگر بافتهای پیوندی ، شامل ماده زمینهای و سلولهای بافت استخوانی است. ماده زمینهای به دو صورت بیشکل و شکلدار وجود دارد.ساختار استخوان
استخوان شامل ماده زمینهای و سلولهای بافت استخوانی است. ماده زمینهای به دو صورت بیشکل و شکلدار وجود دارد. ماده زمینهای بیشکل شامل مواد کانی نظیر فسفات و کربنات کلسیم و منیزیم ، یون سیترات ، یون فلوراید ، سدیم و پتاسیم است. مواد آلی شامل کندروآتین سولفات C و Aو پروتئینی به نام استئوموکوئید و مواد آلی دیگری است که عبارتند از: استئونکتین ، که بلورهای کانی را به کلاژن وصل میکنند. استئوکلسین که کلسیم را به خود میبندد. سیالوپروتئین و پروتئین شکل دهنده استخوان.
|
ماده شکلدار آن ، کلاژن I است. کلاژن به صورت یک هسته مرکزی است که مواد کانی بر روی آن رسوب کردهاند. کل این ترکیبات بلورهای هیدروکسی آپاتیت را تولید میکنند. هیدروکسی آپاتیت تیغههای استخوانی را به شکل دوایر متحدالمرکز میسازد. علاوه بر اینها ماده سومی بنام سیمان وجود دارد که اولا رشتههای کلاژن را به یکدیگر میچسباند، ثانیا سیستمهای هاورسی را به یکدیگر متصل میکند و شکل منظمی به آنها میدهد. سلولهای بافت استخوانی بر چهار نوعاند که همزمان قابل رویت نیستند.
سلولهای بافت استخوانی
استئوسیتها
این سلولها ستارهای شکلاند و دو هسته بیضی و پر از کروماتین دارند. هر استئوسیت در پیرامون خود لاکونا دارد. برای جلوگیری از مرگ سلولی ، استئوسیتها توسط زواید بسیار ظریف سیتوپلاسمی به یکدیگر مرتبط هستند. استئوسیتهایی که در نواحی عمیق یا پیر بافت استخوانی قرار دارند دارای شبکه آندوپلاسمی ناصاف و دستگاه گلژی کمتری هستند. تا زمانی که صدمهای به استخوان وارد نشود، استئوسیتها تقسیم نمیشوند. با ایجاد ضایعه ، تقسیمات سلولها آغاز میشود. تعدادی از آنها به صورت استئوبلاست ، ماده زمینهای بیشکل را میسازند و خود به استئوسیت تبدیل میشوند برخی دیگر به صورت سلولهای اجدادی استخوان باقی میمانند.

|
استئوبلاستها
سلولهایی هستند چند ضلعی با آنزیم فسفاتاز قلیایی فراوان و هستهای که در خارج از مرکز سلول قرار دارد. این سلولها در محلی که فعالیت سازندگی زیاد است فراواناند و دارای شبکه آندوپلاسمی ناصاف و دستگاه گلژی هستند. این دو نشان دهنده فعالیتهای ترشحیاند. به همین دلیل حبابهای ترشحی بسیاری در این سلولها دیده میشود. هنگام فعالیت ، تعدادی از استئوبلاستها به صورت سلولهای اجدادی استخوان ذخیره میشوند. اینها با وجود آنزیم فسفاتاز قلیایی ، قادرند ماده زمینهای بسازند و به همین دلیل سلولهای سازنده خوانده میشوند. هنگام فعالیت مکعبی شکل و بازوفیلی وهنگام استراحت ، پهن و اسیدوفیلی هستند.استئوکلاستها
استئوکلاستها از مونوسیتهای خون تولید میشوند. استئوکلاستها مسئول تجزیه ماده زمینه استخوان در هنگام استخوان سازی هستند. نقش استئوکلاستها عکس استئوبلاستهاست به همین دلیل سلولهای مخرب نامیده میشوند. این سلولها ، ابتدا ماده زمینهای بیشکل و سپس کلاژن را تجزیه میکنند. استئوکلاستها معمولا سلولهایی غول آسا با سیتوپلاسم وسیعاند و تعداد 6 تا 50 هسته دارند.استئوکلاستهای جوان تک هستهای بوده و در هنگام فعالیت بازوفیلی و هنگام استراحت اسیدوفیلی هستند. با وجود اسید فسفاتاز دراستئوکلاستها این سلولها میتوانند ماده زمینهای را تجزیه کنند. به علاوه هنگامی که میزان کلسیم خون به علت عمل هورمون تیروکسین و پاراتورمون کاهش مییابد، استئوکلاست کلسیم را از استخوان میگیرد و به جریان خون میفرستد. استئوکلاستها نزدیک سطح استخوان از حفرهای از ماده استخوانی در حال تخریب قرار دارند.

|
انواع استخوانها
از نظر تشریحی ، دونوع استخوان در بدن وجود دارد: استخوانهای دراز و استخوانهای پهن. استخوانهای دراز معمولا دارای بافت استخوانی متراکم ، و استخوانهای پهن دارای بافت اسفنجی هستند.موضوعات مرتبط: هماتولوژي
ادامه مطلب
سلول های بنیادی یا STEM CELLS به سلول های چند پتانسیلی مغز استخوان گفته می شود كه توانایی تبدیل به انواع سلول های خونی را دارند. توانایی تبدیل این سلول ها به انواع سلول های خونی، توجه دانشمندان و پژوهشگران را به طرف تبدیل این سلول ها به سایر سلول های تخصص یافته ی بافت های دیگر معطوف داشت.
در كلیه ی بافت های بدن نوعی از سلول های بنیادی یافت می شود كه توانایی تبدیل به سلول های تخصص یافته ی همان بافت را دارند و در موقع اختلال بافتی، دست به كار شده و تكثیر پیدا می كنند و به دلیل داشتن همین توانایی به آنها " سلول بنیادی" می گویند.
سلول های بنیادی اصولا سلول های تخصصی نشده ای هستند كه با دو مشخصه مهم از دیگر سلول ها تفكیك می شوند:
اولا توانایی تكثیر و افزایش تعداد برای مدت طولانی را دارند.
دوم اینکه پس از دریافت پیام های شیمیایی معین می توانند تمایز حاصل كنند یا به سلول های تخصص یافته ای با عملكردهای خاص، مثل سلول قلبی یا عصبی تبدیل شوند. عملكرد این سلول ها در بدن این است كه در هنگام اختلال و بیماری تكثیر شده و سلول های جدیدی به بافت ارائه می كنند كه اساس سلول درمانی را تشكیل می دهد.
سلول های بنیادی بر اساس توانایی تكثیر و تمایز به انواع مختلفی تقسیم می شوند:
1- سلول های بنیادی TOTIPOTENT یا همه توانی:
این سلول ها می توانند به هر نوع سلولی در بدن تغییر پیدا كرده و تبدیل شوند. یك تخمك بارور شده در واقع یك نوع سلول بنیادی همه توانی است. سلول های تولید شده در تقسیمات تخمك بارور شده نیز همه توانی هستند.
2- سلول های بنیادی PLURIPOTENT یا پرتوانی:
این سلول ها كه از سلول های بنیادی رویان منشا می گیرند، حدود 4 روز پس از لقاح به وجود می آیند و می توانند به هر نوع سلولی به جز سلول های بنیادی همه توانی و سلول های جفت تبدیل شده و تمایز حاصل كنند.
3- سلول های بنیادی MULTIPOTENT یا چند توانی :
از سلول های بنیادی پرتوانی منشا می گیرند و سلول های تخصص یافته از آنها ناشی می شوند. برای مثال سلول های بنیادی خون ساز كه در مغز استخوان وجود دارند به همه انواع سلول موجود در خون تبدیل می شوند، مثل گلبول قرمز، گلبول سفید و پلاكت. یا سلول های بنیادی عصبی كه می توانند به سلول های عصبی و سلول های حمایت كننده عصبی تبدیل شوند.
4- سلول های بنیادی UNIPOTENT یا تك توانی :
این نوع سلول ها می توانند فقط به یك نوع سلول تبدیل شده و آن را تولید كنند.
* سلول درمانی چیست و چگونه از سلول های بنیادی برای سلول درمانی استفاده می شود؟
سلول درمانی در واقع عمل پیوند سلول های خویش منشا یا اتولوگ است. روشی كه در حال حاضر تحت عنوان سیستم سلولی اتولوگ یا AUTOLOGOUS CELLULAR SYSTEM مطرح می گردد.
در این روش درمانی سلول های خود فرد تكثیر شده و مجدد به محل مورد نظر تزریق می شود تا اختلال ایجاد شده رفع شود
سلول های بنيادی
سلولهای بنیادی سلول های اولیهای هستند که توانائی تبدیل و تمایز به انواع مختلف سلولهای انسانی را دارند و از آنها میتوان در تولید سلولها و نهایتا بافتهای مختلف در بدن انسان استفاده کرد .
منابع اصلی سلولهای بنیادی شامل : مغز استخوان، بند ناف و جفت میباشد . امروزه استفاده از این سلولها جهت ترمیم بافتهای آسیب دیده انسانی در حال گسترش است .
جالب اینکه سلولهای بنیادی چند پتانسیلی هستند یعنی قابلیت تبدیل به بافتهای مختلف را دارند اعم از بافت عصبی ؛ عضلانی ؛ پوششی و غیره. که این توانائی محور اصلی توجه به سلولهای بنیادی است.
مزیت اصلی سلولهای بنیادی بند ناف این است که بسیار اولیه بوده و توان تمایز بالایی دارند.همچنین سلولهای مشتق از مغز استخوان ( BMSCs ) توان تمایز بالایی دارند.
کاربردهای سلولهای بنیادی
- بیماران قلبی:
توصیه میشود برای افرادی که در مراحل وخیم بیماری قلبی بوده و در انتظار دریافت قلب پیوندی بهسر میبرند، در کنار تجویز داروهای سرکوبکننده سیستم ایمنی، از روش پیوند سلولهای بندناف بهعنوان یک روش کمکی استفاده کرد. بر این اساس، این ایده در دنیا مطرح شده است که نمونه
- بیماران کبدی:
پیوند سلولهای بنیادی علاوه بر بیماران قلبی در سایر بیماران نیز نتایج خوبی را نشان داده است. برای مثال، در حال حاضر اگر بیماری دچار سرطان کبد باشد، جراح مجبور است برای جلوگیری از انتشار سرطان (متاستاز) به بخشهای دیگر بدن، بخش سرطانی کبد را نابود کند. برای این منظور معمولاً طی دو عمل جراحی همزمان، خون ناحیه سرطانی کبد را قطع میکنند تا بافت* استفاده سلول های بنیادی در cloning :
یک دودمان سلول بنیادی جمعیتی از سلول ها است که مستمرا تقسیم شده و از بافت های انسان یا دیگر موجودات بدست می آید . محققین برای اهداف درمانی و پژوهشی از سلول های بنیادی جنینی و بالغ استفاده می کنند . Totipotent: این سلول ها توانایی تولید تمام سلول های مورد نیاز یک موجود زنده را داشته و عاقبت آنها مشخص نیست و بر اساس نیاز ، توانایی تبدیل شدن به هر دارند. 3- تماس سلول- سلول باعث متعهد بودن یک سلول بنیادین در لانه گزینی و رشد و تکثیر آن می مامع بيان ژن مي گردد. تحت شرايط نوترکيبي به واسطه cre توالی خاتمه خارج شده و بيان ژن دوباره فعال مي گردد. مدل سازي بيماري ها: توانايي ايجاد جهش هاي جايگاه خاص و ناک اوت کامل ژنها توسط gene targeting منجر به توليد موشهاي مدل براي انواع بيماري ها از جمله بيماريهاي عصبي و متابوليک و خوني شده است. يک مثال مربوط به آلزايمر مي باشد که حداقل بر اثر جهش در 4 ژن ايجاد مي شود . افزايش دز ژن و جهش در پروتئين پيش ساز بتا آميلوئيد (APP) با آلزايمر در ارتباط بوده جهش در زن آپوليپوپروتئين E نيز با ريسک افزايش يافته و کاهش سن شروع بيماري در ارتباط است. امروزه توسط gene targeting در سلول هايES مدل هاي موشي ايجاد شده اند که حاوي يک جهش نقطه اي در ژن APP و يا ژن ApoE ناک اوت شده مي باشند. به کمک BAC و يستم هاي نوترکيبي جايگاه خاص مثل cre/Lox P مدل هايي براي جابه جايي هاي کروموزومي براي سرطانهاي خاص ايجاد کرده اند. رد يابي دودمانها :همانطور که ذکر شد يک استفاده تکنولوزيgene targetiung قرار دادن يک ژن گزارشگر تحت کنترل يک پروموتر اندوژن براي مطالعه الگوي بيان ان ژن مي باشد(knock in) . به کمک اين تکنيک امکان رد يابي دودمانها يا انجام fate mapping توسط دستکاري ژنتيکي را فراهم آورده است . در اين سيستم يک ريکامبيناز جايگاه خاص مثل cre تحت کنترل پروموتر خاصي در دودمان يا cell type خاصي قرار مي گيرد. موشهاي تهيه شده توسط اين سلول هاي ES مي توانند با موش هاي داراي يک ژن گزارشگر همراه با يک توالي خاتمه کراس داده شوند. بيان cre در سلول هاي خاص دودمان که بر اثر نوترکيبي بين جايگاههاي LoxP ، برداشت توالي خاتمه و بيان ژن گزارشگر مي باشد ، انجام مي گيرد . بنابر اين تمام اولاد سلول هاي اوليه بيان کننده cre با ژن گزارشگر نشاندار مي شوند . بدين ترتيب مي توان سرنوشت اخلاف سلول هاي مختلف را طي تکوين دنبال نمود
موضوعات مرتبط: هماتولوژي
ادامه مطلب

سـلولـهای قرمـز خون در مغز استخوان های بزرگ بدن (مثل استخوان لگن) تولید می شـوند. مـغـز اسـتـخــوان بـــرای ســـــاخت هـمـوگـلـوبیـن و گـویچــه های قرمز به آهن، ویتامین B12 و اسـیـد فـولـیک نیاز دارد. یک علت شایع کم خونی فقر آهن میباشد.
علایم کم خونی:
۱-میتواند بدون علامت باشد.
۲-رنگ پریدگی پوست، لثه ها و بستر ناخن ها.
۳-خستگی و ضعف-کاهش بنیه-بی خوابی.
۴-تنگی نفس غیر معمول هنگام فعالیت بدنی.
۵-ضربان قلب تند.
۶-دست ها و پاهای سرد.
۷-سردرد-سرگیجه-احساس سبک شدن سر.
۸-ناخن های شکننده.
۹-وزوز گوش و صدای زنگ در گوش.
۱۰-تحریک پذیری-خواب آلودگی-کاهش توان یادگیری-کاهش تمرکز.
۱۱-التهاب و دردناک شدن زبان.
۱۲-کاهش اشتها به ویژه در نوزادان و کودکان.
۱۳-درد قفسه سینه.
۱۴-عفونتهای مکرر.
۱۵-ویار نامتعارف به مواد غیر غذایی مانند یخ، نشاسته و یا خاک.
۱۶-دشوار شدن بلع.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
موضوعات مرتبط: هماتولوژي
ادامه مطلب
مقدمه :
پلاکتها (Plackets) اجسام کروی یا بیضوی کوچکی به قطر ۴ - ۲ میکرون هستند که از قطعه قطعه شدن سیتوپلاسم سلولهای بزرگی به نام مگا کاریوسیت (Mega karyocytes) در مغز استخوان حاصل میشود، فاقد هستهاند. با وجود این در مهرهداران پست سلولهای هسته داری به نام ترومبوسیت معادل پلاکت میباشد. پلاکتها را ترومبوسیت نیز مینامند. تعداد پلاکتها ۴۰۰ - ۲۰۰ هزار در هر میکرولیتر خون میباشد. و عمر آنها ۱۱ - ۸ روز میباشد. هر پلاکت توسط غشایی غنی از گلیلو پروتئین محصور شده و بررسیها بیانگر وجود آنتی ژنهای گروههای خونی ABO در غشای پلاکتها میباشد.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
ويتامين B12 يا «كوبالامين»
ويتامين B12 يا «كوبالامين»، يكي از مهمترين و پيچيدهترين ويتامين هايي است كه براي بشر شناخته شده است. به گزارش ايسنا، كمبود ويتامين B12 به ميزان خيلي كم ميتواند منجر به كمخوني، خستگي، جنون و افسردگي شود، در حالي كه دوره طولاني كمبود اين ويتامين ميتواند براي هميشه به مغز و سيستم اعصاب مركزي آسيب برساند.
ويتامين B12 به طور طبيعي تنها در فرآوردههاي حيواني يافت مي شود، گرچه صور تركيبي آنها به طور وسيعي در دسترس هستند و به بيشتر غذاها مانند غلات اضافه ميشوند. ويتامين B12 ميتواند به ميزان زيادي مصرف شود زيرا مازاد آن توسط بدن دفع شده و يا در كبد ذخيره ميشود. ذخيره ويتامين B12 ميتواند به مدت يك سال دوام داشته باشد. در زير ليستي از مواد خوراكي سرشار از ويتامين B12 آمده است:
جگر بيشتر حيوانات سرشار از ويتامين B12 است كه بيشترين ميزان آن در جگر گوسفند، گاو، گوساله، گوزن الك، بوقلمون، اردك و غاز يافت ميشود. در هر 100 گرم از جگر گوسفند ميزان 85.7 ميكروگرم ويتامين B12 وجود دارد.
خاويار و تخم ماهي اغلب به عنوان چاشني و مخلفات مورد استفاده قرار ميگيرد. تخم ماهيان سفيد حاوي بيشترين ويتامين B12 است كه در هر 100 گرم آن حدود 56.4 ميكروگرم ويتامين يافت ميشود.
ماهي، علاوه بر اينكه منبع غني از ويتامين B12 به حساب ميآيد سرشار از امگا 3 و پروتئين است. به طور مثال در هر 100 گرم ماهي ماكرو حدود 19 ميكروگرم ويتامين ويتامين B12 يافت ميشود و در ماهياني مانند ماهي از خانواده كليكاها، ماهي آزاد، ماهي هوور، ماهي روغن، ماهي ساردين، بلوفيش و ... مقدار قابل توجهي از اين ويتامين يافت ميشود.
خرچنگها كه اغلب به صورت بخارپز مورد مصرف قرار ميگيرند در هر 199 گرم آن حاوي 11.5 ميكروگرم ويتامين B12 وجود دارد.
صدفها منبع غني ويتامين B12 به حساب ميآيند و ميتوانند به طور خام، پخته شده، بخارپز، سرخشده يا به صورت آبگوشت مصرف شود. صدفهاي خوراكي علاوه بر ويتامين B12 شامل مقدار زيادي روي، مس و آهن هستند.
صدفها منبع غني ويتامين B12 محسوب ميشوند و خوردن 100 گرم از آن ميتواند ميزان 98.9 ميكروگرم ويتامين B12 را تامين كند.
گوشت گاو علاوه بر اينكه منبع غني ويتامين B12 به حساب ميآيد سرشار از پروتئين، روي و آهن ميباشد. ميزان اين ويتامين در گوشت گاو نسبت به قسمتهاي مختلف آن فرق ميكند.
گوشت گوسفند، گوشتي است كه به طور رايج در خاورميانه، مديترانه، جنوب آسيا، استراليا، نيوزيلند و بيشتر قسمتهاي اروپا مورد استفاده قرار ميگيرد. گوشت گوسفند سرشار از كلسترول ميباشد و در قسمتهاي مختلف آن منابع غني از ويتامين B12 نيز يافت ميشود. گوشت گوسفند همچنين مقدار زيادي پروتئين و روي را فراهم ميكند.
قسمت گوشت سردست (كتف) گوسفند حاوي بيشترين مقدار ويتامين B12 است كه 100 گرم از آن حدود 3.71 ميكروگرم از اين ويتامين را تامين ميكند. همچنين گوشت كتف كه به قسمت قلم ساق و ران گوسفند ميرسد حدود 51 درصد مصرف روزانه توصيه شده ما را تامين ميكند.
پنير با وجود اينكه سرشار از كلسترول ميباشد به عنوان منبع غني از كلسيم، پروتئين و ريبوفاوين (ويتامين B2) نيز محسوب ميشود. ميزان ويتامين B12 موجود در پنير بسته به نوع آن فرق ميكند. براي مثال پنير سوئيس بيشترين ويتامين B12 را داراست و مصرف 100 گرم آن 3.34 ميكروگرم ويتامين B12 را تامين ميكند. مصرف زرده خام تخم مرغ داراي بيشترين ميزان ويتامين B12 است كه در هر 100 گرم آن 1.95 ميكروگرم از اين ويتامين وجود دارد. تخم پرندگان ديگر مانند غاز حدود 7.34 ميكروگرم و تخم اردك به ميزان 3.78 ميكروگرم ويتامين B12 را تامين ميكند.
موضوعات مرتبط: هماتولوژي
RED BLOOD CELL
هدف:شمارش گلبول قرمز در يك ميليمتر مكعب خون
تئوري:
بيماري کم خوني
تاريخچهاولين قدم در درک ژنتيک امراض هموگلوبين در سال ۱۹۴۹ بوسيله "نيل" (Neel) برداشته شد. او نشان داد مبتلايان به اختلالات خوني که به مرض سلولهاي داسي شکل معروف است نسبت به يک ژن که همين اختلال با شدت کمتر را در هر دو والد هتروزيگوس بوجود ميآورد، به صورت هموزيگوس هستند. چند سال بعد (Pauling) و همکارانش مرض سلولهاي داسي شکل را به عنوان نخستين بيماري مولکولي که در آن هموگلوبين غير طبيعي باعث نقص ميشد، تشخيص دادند. سپس اينگرام (Ingram) متوجه شد نقص هموگلوبين در مرض سلول داسي شکل در اثر جايگزيني فقط يکي از ۲۸۷ اسيد آمينه مولکول هموگلوبين است.
موضوعات مرتبط: هماتولوژي
ادامه مطلب

( White Blood Cell Count (WBC
هدف: شمارش گلبول سفيد در يك ميليمتر مكعب خون
وسايل مورد نياز: لام هموسيتومتر(بهتر است نئوبار باشد)، لامل سنگين، پيپت ملانژورسفيد، لوله لاستيکي (مکنده)حدود ۲۵ سانتيمتر، محلول رقيق کننده ي مارکانو(۲ml اسيد استيك+ ۹۸ml آب مقطر) ، محلول کريستال ويوله يا بلودومتيلن۱%، ميکروسکوپ
*****
*لام نئوبار يا توما:
از دو مستطيل شفاف در وسط تشكيل شده است كه داراي درجه بندي براي شمارش گلبول سفيد و قرمز است. هر مستطيل در زير ميكروسكوپ به صورت يك مربع ۳ ميليمتري كه به ۹ مربع ۱ ميليمتري تقسيم شده است مشاهده مي شود. مربع هايي كه در چهارگوشه قرار دارند مسئول شمارش گلبول سفيد مي با شند و مربعي كه در وسط قرار دارد داراي تقسيم بندي ريزي است كه براي شمارش گلبول قرمز مي باشد
* پيپت ملانژورسفيد white bead in the bulb:
اين پيپت براي رقيق کردن خون بکار ميرود که درحباب آن يک مهره سفيد وجود دارد، روي پيپت ملانژور سفيد سه عدد ۵/۰ و ۱ و ۱۱ قرار دارد.
*****
موضوعات مرتبط: هماتولوژي
ادامه مطلب
گلبول های قرمز نرمال . لنفوسیت کوچک در وسط میدان

ادامه تصاویر در ادامه مطلب.........
موضوعات مرتبط: هماتولوژي
ادامه مطلب
هدف: اندازه گیری هموگلوبین خون (اچ - بی)
تئو ری آزمایش:
هموگلوبین در آزمایشگاه به دو روش اندازه گیری می شود :
۱- اندازه گیری هموگلوبین به روش دستی
۲- اندازه گیری هموگلوبین به روش دستگاهی (با دستگاه تمام الکترونیکی)
با وجود دستگاههای پیشرفته الکترونیکی روش دستی هنوز هم جایگاه خاص خود را در آزمایشگاههای طبی حفظ کرده است
معرفی هموگلوبین:
گویچههای قرمز خون حاوی مولکول پیچیدهای به نام هموگلوبین میباشد که هموگلوبین از یک قسمت پروتئینی به نام گلوبین و یک رنگدانه آهندار به نام هِم تشکیل شده است. گلوبین مرکب از ۴ زنجیره پلی پپتیدی است که به هر زنجیره یک پورفیرین آهندار(هِم) متصل شده است.
بر اساس نوع زنجیرههای پلی پپتیدی سه نوع هموگلوبین (Hb) در انسان قابل تشخیص میباشد که شامل:
۱- HbA12 که ۲% هموگلوبین افراد بالغ را تشکیل میدهد و گلوبین آن مرکب از دو زنجیره آلفا و دو زنجیره دلتا میباشد.
۲- HbF که حدود ۱% هموگلوبین بالغین را تشکیل میدهد و در ساختمان گلوبین آن دو زنجیره آلفا و دو زنجیره گاما شرکت دارند، است HbF. در دوره جنین ، هموگلوبین غالب میباشد و پس از تولد بوسیله HbA1 جایگزین میگردد.
یکی از راههای تخمین میزان گویچههای قرمز خون ، اندازه گیری مقدار هموگلوبین با استفاده از دستگاه اسپکترو فتومتر میباشد. در این روش که مقدار هموگلوبین برحسب گرم در دسی لیتر بیان میگردد. در مردان ۱۸ - ۱۴ گرم بر دسی لیتر و در زنان ۱۶ - ۱۲ گرم بر دسی لیتر میباشد.
نقش مولکول هموگلوبین :
هموگلوبین به علت داشتن آهن که در حالت احیا شده میباشد، میتواند با اکسیژن و دیاکسید کربن ترکیب شده و به ترتیب اکسی هموگلوبین (oxyhemoglobin) و کربو آمینو هموگلوبین (carbaminohemoglobin) تشکیل دهد. با توجه به بالابودن فشار اکسیژن در ریهها ، اکسی هموگلوبین در ریهها تشکیل شده و پس از رسیدن به بافتها ، اکسیژن جدا شده و دیاکسید کربن به CO2 آن متصل میگردد. به این ترتیب امکان حمل اکسیژن از ریهها به بافتها و دیاکسیدکربن از بافتها به ریهها امکانپذیر میگردد. از طرف دیگر سطح بسیار زیاد گویچههای قرمز نسبت به حجم آنها (به علت داشتن شکل مقعرالطرفین) سبب تسریع و تسهیل اشباع هموگلوبین با اکسیژن در ریهها میشود. علاوه بر انتقال اکسیژن توسط هموگلوبین ، این مولکول عمل دیگری نیز انجام میدهد و آن عبارت از تثبیت فشار اکسیژن در بافتها است.
تشکیل مولکول هموگلوبین :
سنتز مولکول هموگلوبین در گلبولهای قرمز اولیه شروع میشود و تا زمانی که گلبول قرمز ، مغز استخوان را ترک میکند و وارد خون میشود، برای حدود یک روز به تشکیل مقادیر ناچیزی هموگلوبین ادامه میدهند. هر مولکول هم پس از تشکیل شدن با یک زنجیره پلی پپتیدی بسیار دراز موسوم به گلوبین که در ریبوزومها ساخته میشود، ترکیب شده و یکی از اجزا هموگلوبین موسوم به یک زنجیره هموگلوبین را تشکیل میدهد.
هر یک از این زنجیرهها دارای وزن مولکولی ۱۶۰۰۰ بوده و چهار عدد از آنها به نوبه خود بطور سست به یکدیگر متصل شده و مولکول کامل را میسازند. چون هر زنجیره یک گروه هم دارد، چهار اتم آهن در هر مولکول هموگلوبین وجود دارد که هر یک از آنها میتواند یک مولکول اکسیژن را حمل کند. هموگلوبین دارای وزن مولکولی ۶۴۴۵۸ دالتون است.
کم خونی داسی شکل :
ناهنجاریهای زنجیرههای هموگلوبین میتواند مشخصات فیزیکی مولکول هموگلوبین را تغییر دهد. به عنوان نمونه ، در آنمی داسی شکل ، اسید آمینه والین ، جایگزین اسید گلوتامیک در یک نقطه در هر یک از دو زنجیره بتا میشود. هنگامی که این نوع هموگلوبین در معرض فشار اکسیژن پایین قرار میگیرد، بلورهای درازی در داخل گویچههای سرخ تشکیل میدهد که گاهی 15 میکرومتر طول دارند. این بلورها عبور گویچههای سرخ از مویرگهای کوچک را تقریبا غیر ممکن میسازند و انتهای تیز و سرنیزهای به احتمال زیاد غشاهای گویچهای را پاره کرده و به این ترتیب منجر به آنمی داسی شکل میشوند.
تخریب هموگلوبین :
عمر گویچههای قرمز خون حدود ۱۲۰ روز میباشد و پس از پایان این مدت بوسیله ماکروفاژها در طحال ، کبد و مغز استخوان فاگوسیته میشوند. پس از فاگوسیته شدن گویچه قرمز ، بخش پروتئینی هموگلوبین به اسیدهای آمینه تجزیه میشود و آهن آزاد شده به پروتئینها متصل شده و به صورت هموسیدرین یا فریتین در داخل آنها ذخیره میشود و در مواقع لازم پس از حمل به مغز استخوان ، برای سنتز هموگلوبین جدید مورد استفاده قرار میگیرد. پورفیرین به بیلیروبین تبدیل و پس از حمل به کبد به صورت محلول در آمده و همراه صفرا دفع میگردد.
تحت شرایط ویژهاینظیر قرار گیری در محلولهای هیپوتونیک و یا تحت تاثیر موادی مانند سم مار ، هموگلوبین از درون گویچههای قرمز خارج میگردد که این حالت را همولیز (hemolysis) مینامند. هموگلوبین ، پس از همولیز ، سرنوشتی مانند هموگلوبین گویچههای قرمز فاگوسیته شده پیدا میکند. به همین دلیل ، درصورتی که همولیز به حدی باشد که کبد قادر به دفع همه بیلیروبین تشکیل شده نباشد، یرقان پدید میآید که با توجه به علت پیدایش آن ، یرقان همولیتیک نامیده میشود.
اندازه گیری هموگلوبین به روش دستی:
وسایل مورد نیار :
۱- دستگاه فتومتر
۲- پیپت مخصوص هموگلوبین که با آن بتوان مقدار دقیق 20 میکرولیتر خون بر داشت
۳- یک عدد لوله مکنده
۴- محلول دارابکین (DROBKINS) که به صورت کیت آماده در بازارموجود است
تذکر بسیار مهم :
محلول دارابکین فوق العاده سمی است . از تماس آن با پوست دست جدا خودداری گردد.در صورت تماس محل باید با آب فراوان شسته شود. لذا درهنگام کار با محلول دارابکین باید از پی پتور مخصوص بدون دخالت دهان استفاده شود.
محلول دارابکین باید شفاف به رنگ زرد کم رنگ باشد . نگه داری محلول در پیپتور شیشه ای به رنگ تیره انجام می شود با این شرایط محلول برای مدت چند ماه در حرارت آزمایشگاه قابل استفاده است.
روش کار:
کار با نمونه گیری از نوک انگشت آغاز شد. ابتدا نوک انگشت را توسط پنبه آغشته به الکل ضد عفونی میکنیم . بعد توسط یک ضربه لا نست نوک انگشت را سوراخ کرده, خون جریان پیدا میکندو ۲۰ میکرو لیتر خون به وسیله پیپت مخصوص به لوله آزمایش حاوی cc ۵ محلول دارابکین اضافه می کنیم. اسم این لوله را لوله تست نهادیم . سپس سر لوله را توسط پارافیل می بندیم و محلول را همگن می کنیم ده دقیقه زمان میدهیم تا واکنش صورت گرفته و رنگ قهوه ای شفاف ظاهر شود .دستگاه فتومتر را روشن کردیم.وطول موج ۵۴۰ نانومتر را روی آن انتخاب نمودیم . دستگاه را بوسیله ماده دارابکین صفر می کنیم به این صورت که در داخل لوله کووت مخصوص دستگاه فتومترمحلول دارابکین می ریزیم کووت را داخل دستگاه فتومتر قرار می دهیم حالا دستگاه را روی عدد صفر تنظیم میکنیم . محتوی کووت را خالی می کنیم .حالا محلول لوله تست را داخل کووت می ریزیم کووت را در دستگاه قرار می دهیم.
عددجذب نوری را که دستگاه نمایش می دهد یادداشت میکنیم :
میزان هموگلوبین= جذب نوری تست × غلظت استاندارد
موضوعات مرتبط: هماتولوژي
تئوري آزمايش: اصطلاح هماتوکريت براي اندازه گيري غلظت خون يا به عبارت ديگر تعيين حجم گلبول هاي قرمز خون بکار ميرود
آزمايش هماتوکريت به عنوان ساده ترين ودر اصل مهمترين آزمايش براي تشخيص کم خوني ها( آنمي ها) در پزشکي کار برد دارد.
تعريف علمي هماتوکريت خون HCT : مقدار درصد حجمي که گويچه هاي قرمزپس از سانتر يفيوژ کردن خون اشغال مي کنند را هماتوکريت گويند. به عبارت ديگر هماتوکريت عبارت است از نسبت حجم گلبولهاي قرمز فشرده شده به حجم خون تام که بر حسب در صد گزارش ميشود.
نرمال هماتوکريت :درمردان ۴۹%-۴۰%
درزنان ۴۴%-۴۰%
* مقدار نرمال هماتوکريت با جنس و سن وارتفاع ازسطح دريا وغيره بستگي دارد
وسايل مورد نياز:۱. دستگاه سانتريفيوژميکروهماتوکريت
۲. لوله هاي موئينه(کاپيلري) با حلقه قرمز
۳. خمير مخصوص
۴. لانست
۵. پنبه
۶. الکل
۷. خط کش مخصوص
*دو نوع لوله موئينه وجود دارد:
الف- لوله هاي موئينه ساده که فاقد ماده ضد انعقاد ند مشخصه اين لوله ها وجود حلقه آبي رنگ در بالاي لوله است,اينها براي نمونه هايي که باماده ضد انعقادي EDTA تهيه شده اند استفاده ميشوند
ب- لوله هاي موئينه ضد انعقاد دار(هپارينه) داخل اين لوله ها آغشته به ماده ضدانعقاد هپارين هستند. وجود حلقه قرمزرنگ در بالاي لوله مشخصه آنهاست براي گرفتن خون از نوک انگشت يا پاشنه پا در نوزادان استفاده ميشوند، ما اکنون از اين نوع لوله استفاه مي کنيم.
روش کار: ابتدا نوک انگشت را توسط پنبه آغشته به الکل ضد عفوني ميکنيم . بعد توسط يک ضربه لانست نوک انگشت را سوراخ کرده، خون جريان پيدا ميکند قطره اول خون راحذف مي کنيم. لوله موئينه را روي خون نوک انگشت گذاشته تا دو سوم لوله موئينه از خون پر شود. حالا طرف ديگر لوله را توسط انگشت نشانه مي بنديم تا خون از لوله خارج نشود نوک لوله موئينه را با چند بارفرو بردن در داخل خمير مخصوص مسدود مي کنيم.
لوله موئينه را در دستگاه سانتريفيوژ طوري قرار مي دهيم که نوک بسته شده لوله به طرف خارج روي واشر لاستيکي دستگاه وسر باز لوله بطرف داخل دستگاه قرار گيرد. صفحه محافظ دستگاه را مي بنديم دستگاه راروشن مي کنيم تايمردستگاه رابراي مدت پنج دقيقه کوک مي کنيم .
وقتي دستگاه کاملا از حرکت ايستاد، لوله موئينه را از آن خارج مي کنيم . حالاخون داخل لوله موئينه به سه قسمت تقسيم شده است:
۱. گويچه هاي قرمز متراکم
۲. يک لايه خيلي نازک سفيد رنگ به نام بافي کت شامل گويچه هاي سفيد وپلاکت ها
۳.پلاسماي خون
لوله موئينه را روي خط کش مخصوص قرار داده با حرکت لوله روي خط کش وضعيتي را به وجود مي آوريم که فصل مشترک بين خمير وخون روي عدد صفر و آخرين سطح پلاسما روي عدد صد قرار گيرد حالا عددي که طول ستون گويچه هاي قرمز رانشان مي دهد هماتوکريت شخص ميباشد در تمام مراحل خواندن هماتوکريت بايد از بالا با زاويه ۹۰درجه به صفحه نگاه کنيم.
نکات: ۱. سرعت دستگاه دوازده هزار دور در دقيقه است.
۲. ممکن لوله موئينه داخل دستگاه سانتريفيوژ ميکروهماتوکريت بشکند.
علت:
۱. عدم تعادل: براي جلوگيري از شکستن لوله بايد کار را با دو لوله آغاز کنيم.جهت حفظ تعادل بايد دو لوله مقابل هم در دستگاه قرار داده شوند.
۲. علت ديگر شکستن لوله داخل دستگاه مربوط به افراد تازه کاراست. که فراموش ميکنند درب محافظ دستگاه را ببندند و يا آنرا محکم کنند.
موضوعات مرتبط: هماتولوژي
گروهي
از كم خوني ها هستند كه در آنها اريتروبلاستها و نيز ساير پيش سازهاي سلول
هاي خوني (پيش سازهاي گلبولهاي سفيد) دگرگونيهاي غير عادي و ويژه اي در
بلوغ نشان مي دهند كه پيامد آن تأخير بلوغ هسته نسبت به سيتوپلاسم است .
در اين سلولها كروماتين هسته ظاهري ظريف و توري شكل با نماي باز و غير متراكم دارد.
در اين كم خوني توليد هموگلوبين در سيتوپلاسم به صورت طبيعي ادامه دارد و بلوغ سيتوپلاسمي بدون مشكل است .
كم
خوني مگالوبلاستيك معمولاً به علت كمبود اسيدفوليك و B12 رخ مي دهدو كمبود
B12 و يا اسيدفوليك باعث اختلال در ساخت DNA در هسته سلولها مي گردد و در
نتيجه هسته سلولها رشد كافي ندارند و بزرگ باقي مي مانند و سلول بزرگتر از
اندازه طبيعي مي گردد (مگالوبلاستيك ).
كم خوني ماكروسيتي است و ماكرواوالوسيت ها،نوتروفيل هاي غول آسا هيپرسگمانته در خون مشاهده مي گردند.
در
يك كم خوني ماكروسيتي نورموبلاستيك (غير مگالوبلاستيك) نوتروفيلهاي غول
آساي هيپرسگمانته و ماكرو اوالوسيت ها در خون محيطي مشاهده نمي شوند(مانند
كم خوني به علت هيپوتيروئيديسم ) .
پان ستيوپني معمولاً وجود دارد.MCV افزايش دارد،آنيزوسيتوز،پويكيلوسيتوز واضح وجود دارند.
ميكروسيت ها و داكروسيت ها ديده مي شوند.
بازوفيلي منقوط،اجسام هاول ژولي، گلبولهاي قرمز هسته دار و يا مگالوبلاست ها ممكن است ديده شوند .
گرانولوسيت ها اكثراً بيش از 5 لوب دارند( هيپرسگمانتاسيون )
سلولهاي مغز استخوان مگالوبلاستيك هستند(بزرگتر از اندازه معمول با هسته غير طبيعي)
هيپرپلازي شديد رده اريتروئيدي وجود دارد كه به علت خونسازي غير مؤثر موجب بروز كم خوني مي گردد .
دركم
خوني مگالوبلاستيك ساخت DNA دچار مشكل است نه RNA بنابراين هسته سلولهاي
خوني حالت غير طبيعي دارند و بلوغ آنها عقب افتاده است و بزرگ بوده نماي
كروماتيني بازي دارند به علت عدم مشكل در ساخت RNA ، سيتوپلاسم سلولها به
درستي رشد كرده و تكامل مي يابد.
به غير از رده سلولهاي قرمز، رده
ميلوئيدي نيز دچار مشكلات ذكر شده مي باشد.به طور مثال سلولهاي پيش ساز
گرانولوسيتي از نظر اندازه بزرگتر هستند و هسته آنها حالت غير طبيعي
دارد.متاميلوسيت غول آسا مشخص ترين پيش ساز رده گرانولوسيتي در مغز
استخوان مگالوبلاستيك است .
مگاكاريوسيت ها نيز در مغز استخوان مگالوبلاستيك غير طبيعي مي باشند.
به علت هايپرپلازي شديد اريتروئيدي، نسبت ميلوئيد به ارتيدوئيد M/E در مغز استخوان كاهش نشان مي دهد.
یک ماکرو اوالوسیت (فلش) و یک نوتروفیل هایپر سگمانته در گستره خون بیمار مبتلا به كم خوني مگالوبلاستيك
یک مگالوبلاست در گستره خون فرد مبتلا به کم خونی مگالوبلاستیک. این سلولها ممکن است در خون محیطی مشاهده شوند اما معمولا در گستره مغز استخوان بیمار مبتلا شایع هستند.
گستره مغز استخوان در فرد
مبتلا به کم خونی مگالوبلاستیک. مگالوبلاستها در مراحل مختلف بلوغ و یک
متامیلوسیت غول اسا (فلش) مشاهده میشوند.
مقایسه اریتروپویزیس مگالوبلاستیک با اریتروپوپزیس طبیعی. پیش سازهای مگالوبلاستیک بزرگتر بوده هسته انها تراکم کمتری داشته و اصطلاحا بازتر بوده وبلوغ به تعویق افتاده دارد
موضوعات مرتبط: هماتولوژي
هموگلوبين A1C
بررسي هموگلوبين گليكوزيله (HbA1C) نشانهاي از ميزان متوسط گلوكز خون درعرض دو تا سه ماه گذشته است. امروزه اين آزمايش روش ترجيحي براي بررسي كنترل ديابت مي باشد . اين مسئله ثابت شده است كه كنترل قند خون باعث جلوگيري يا تأخير در پيشرفت عوارض عروق كوچك در ديابت مي گردد و روند ايجاد رتينوپاتي، نوروپاتي و نفروپاتي و بيماري عروق كرونري را كند كرده يا از ايجاد آنها جلوگيري مي كند. سطح نرمال HbA1C در افراد طبيعي بين 4% تا 6% مي باشد .درافراد ديابتي كه تحت درمان مي باشند و ميزان HbA1C آنها 2/7% مي باشد در مقايسه با افرادي كه ميزان HbA1C آنها 9% است، 50% تا 70% كاهش عوارض مشاهده شده است. در مطالعاتي در كشورهاي انگلستان و ژاپن مشاهده شده كه عوارض عروق كوچك (ميكروآنژيوپاتي) با كاهش HbA1C از 9/7 به 7، 25% كاهش يافته است.ازآنجاکه نيمه عمر گلبول قرمز حدوداً 120 روز است. بنابراين سنجش HbA1C نشان دهنده كنترل قند خون در عرض دو تا سه ماه قبل ميباشد. از اين رو انجمن ديابت آمريكا بررسي سطح HbA1C را هر سه ماه جهت كنترل قند خون پيشنهاد مي كند.از مزاياي مهم اين آزمايش آن است كه مي توان نمونه را در هر زمان گرفت، زيرا تحت تأثير تغييرات كوتاه مدت (مانند غذا،ورزش) قرار نمي گيرد.انجام آزمون HbA1C در موارد زير توصيه مي گردد؛
- تعيين طول مدت هيپرگليسمي در مبتلاياني كه تازگي ديابت آنان تشخيص داده شده است.
- ارزيابي موفقيت درمان ديابت و ميزان پذيرش و پاسخدهي بيمار.
- مقايسه موفقيت نتايج روشهاي درماني گذشته و جديد در بيمار
- بيماران باردار مشكوك به ديابت حاملگي.
- كاربرد ديگر آن تخمين متوسط گلوكز تمام ساعات شبانه روز بيمار در طي سه ماه گذشته مي باشد كه در جدول زير نشان داده شده است. (حدود mg/dl 30 افزايش به ازاي هر يك درصد HbA1C).
موضوعات مرتبط: هماتولوژي
نحوه اماده سازی اسمیر
ابتدا با لوله موئین از خونی که قبلا تهیه کرده ایم برمیداریم و سپس اولین قطره خارج شده از لوله موئین را به بیرون میریزیم . بعدا قطره خون دومی را طوری در انتهای اسلاید میچکانیم که فاصله ای در حدود یک سانتیمتر با لبه اسلاید ها باقی بماند .
در ادامه اسلاید یا لام خود را در یک سطح صاف قرار میدیم و با یک لام تمیز دیگر که دارای لبه های صافی است در 45 درجه ای (در بعضی منابع 30 درجه ) لام اولی قرار میدیهم تا گسترش نازک و یکنواختی را ایجاد کنیم . برای این کار ما لام دومی را به قطره خون نزدیک میکنیم (لام دومی جلوتر از قطره خون قرار دارد ) سپس به خون اجازه میدیهم که در طول عرض لام دوم پخش شود . بعدا در همان شرایط و همان زاویه اسلاید دوم را در روی اسلاید اول به آهستگی و بدون فشار به سمت چپ (یا راست در افراد چپ دست ) حرکت میدهیم مواظب باشید که گسترش به لبه های اسلاید نرسد و مانند مرحله اول 1 سانتیمتر را با لبه ها فاصله بگزارید . مهمترین بخش در تهیه اسمیر زاویه ای است که بین دو لام قرار دارد چون اگر زاویه بیتشر از 45 درجه باشد گسترش ما ضخیم تر خواهد شد و اگر کمتر از 45 درجه باشد گسترش نازک تر خواهد شد بنابراین سعی کنید که در طول تهیه اسمیر همان زاویه 45 درجه را حفظ کنید تا به یک گسترش استاندارد دست یابید . در یک گسترش استاندارد میزان غلظت سلولها در ابتدای اسمیر دو برابر سلولها در انتهای اسیمر است .
بعد از این کارها اسمیر را باید به آهستگی و دقت خشک کرد این کار به آسانی با گردش دایره ای اسمیر در هوا انجام میگیرد ( در این مرحله اسمیر را از لبه ها بگیرید) . برای نگه داشتن اسمیر به مدت کم اسمیر را به صورت کج ، به طوری که قسمت نازک گسترش در سمت پایین قرار گیرد ، نگه میداریم .
برای بایگانی و یا ذخیره اسمیر به مدت زیاد ، توجه کنیم که گسترش در طرف بالا باشد و ان را درون کشویی قرار دهیم تا از دسترسی حشرات و غبار به دور باشد .
بهترین رنگ امیزی اسمیر ، زمانی است که اسمیر ما به طور کامل با هوا آزاد خشکانیده شود . (4 تا 5 ساعت بعد از تهیه اسمیر ) در شرایط فوری ممکن است رنگ امیزی زودتر انجام گیرد .
موضوعات مرتبط: هماتولوژي
باند نوتروفیل
اندازه:10 تا 16 میکرون
شکل:کروی یا بیضی
نسبت هسته به سیتوپلاسم:1 به 1
شکل هسته: کشیده ونعلی یا نواری شکل.(نازکتر از متامیلوسیت است)
کروماتین: متراکم
هستک: دیده نمیشود
میزان سیتوپلاسم: فراوان
رنگ:سیتوپلاسم: صورتی
گرانول: گرانولهای ریز فراوان
1- باند ، 2- متا میلوسیت
اسمیر خون محیطی. یک باند (1) و یک نوتروفیل(2) مشاهده میشوند
اسمیر مغز استخوان. باند (1) ، میلوسیت نوتروفیلی(2)، میلوسیت ائوزینوفیل (3)
نوتروفیل
اندازه: 12 میکرون
شکل: کروی
نسبت هسته به سیتوپلاسم: کم
شکل هسته: لوبوله شده. 2-5لوب.اکثر نوتروفیلها 3 لوب دارند.
کروماتین: متراکم ترین در رده نوتروفیلی.خشن و توده توده است
هستک:دیده نمیشود
میزان سیتوپلاسم: فراوان
رنگ:سیتوپلاسم: صورتی
گرانول: گرانولهای ریز فراوان
اسمیر مغز استخوان. نوتروفیل (1) ، پرومیلوسیت (2).
اسمیر خون محیطی. نوتروفیل (1) لنفوسیت (2)
ائوزینوفیل
اندازه:13 میکرون
شکل:گرد
نسبت هسته به سیتوپلاسم:کم
شکل هسته:معمولا دو لوب دارد
کروماتین: خشن وتوده توده
هستک:دیده نمیشود
میزان سیتوپلاسم: فراوان
رنگ سیتوپلاسم: ابی روشن که با گرانولهای درشت پرتغالی رنگ پوشیده شده است
سه ائوزینوفیل در اسمیر مغزاستخوان.
یک ائوزینوفیل (1) و یک نوتروفیل (2) در اسمیر مغز استخوان
اسمیر مغزاستخوان. ائوزینوفیل (فلش زرد) .
پرومیلوسیت(1) ،بازوفیلیک نورموبلاست (2) ، میلوسیت(3) ، متامیلوسیت (4) ،
اورتوکروماتیک نورموبلاست (5) ، پلی کروماتوفیلیک نورموبلاست(7)
موضوعات مرتبط: هماتولوژي
ادامه مطلب
-
ساختمان EDTA

این ضد انعقاد به وسیله عمل جذب و جداسازی (Chelating) مانع روند ابشاری انعقاد می شود . EDTA بهترین نوع ضدانعقاد برای مطالعه گسترش خون محیطی است و برای تستهای انعقادی مصرف نمی شود چون فاکتور 5 و8 در مقابل EDTA نا پایدار است.EDTAنمک های سدیم یا پتاسیم از ضد انعقادهای مناسب برای آزمایشات روزمره خونشناسی مانند HCT,RETIC,HGB,CBC,PLT می باشند .
-
انواع EDTA
EDTAبه صورت اسید آزاد به تنهایی بعنوان ضد انعقاد مصرف نمیگردد و بیشتر نمکهای آن مورد استفاده است . EDTA به طور کلی سه نوع است :
EDTA دی سدیک به همراه دو ملکول آب | EDTA-NA2,2H2O
-
به صورت پودر کریستال بدون بو میباشد.
-
حلالیت آن در حرارت 20 در سانتی گراد میباشد.
با دو مولکول آب دی پتاسیکEDTA | EDTA-K2,2H2O
-
قابلیت حلالیت بیشتری داشته و به توصیه ICSH بهترین نوع EDTA است .
EDTA-K3 | EDTA تری پتاسیک
-
بصورت مایع مصرف میشود به راحتی در آب حل میشود وغلظت 15 گرم درصد تهیه کرده به هر لوله حدود 054/0 سی سی که معادل 7میلی گرم پودر است برای 5 سی سی خون اضافه می کنیم .
-
PH آن بین 8-7 است.
-
نکات مهم در مورد EDTA
-
زمان نگه داری نمونه در حرارت اتاق بیش از 6 ساعت نباشد.
-
در دمای یخچال تا 24 ساعت مقادیر پارامترهای خونی PCV,WBC,RBC,PLT,MCV,HG ثابت است.
-
MPV بیش از یک ساعت نباید از زمان نمونه گیری گذشته باشد.
-
مقدار بیش از 2 میلی گرم EDTA به ازا هر سی سی خون سبب کاهش قابل توجه هماتوکریت و در نتیجه افزایش MCHC خواهد شد.
-
افزایش میزان EDTA موجب افزایش کاذب واکنش های انعقادی شود.
-
این ماده روی فاکتور 5 و8اثرات تخریبی داشته و از این رو ضد انعقاد سفارش شده برای آزمونهای انعقادی سیترات سدیم می باشد.
-
پدیده اقماری شدن پلاکت ها منحصرا با ضد انعقاد EDTA گزارش شده .دراین پدیده پلاکت ها دور نوتروفیل ها و منو سیت ها بصورت اقماری ظاهر می شوند.این پدیده باعث میشود که شمارش پلاکت های بیمار بطور چشمگیری کاهش یابد.
-
چنانچه خون دارایEDTA آلوده به انگل مالاریا باشدو به مدت طولانی بماند جهت تشخیص رنگدانه های آن مناسب نیستند.
-
اگر خون در EDTAبیش از 6 ساعت بماند گلبولهای قرمز حالت کروی پیدا می کنند
-
هسته لنفوسیتها و منوسیتها منشعب شده بصورت برگ شبدری در آمده وبا واکوئلهای سیتوپلاسمی همراه می شوند. نوتروفیلها بصورت یک لوب ظاهر می شوند.
-
نا کافی بودن EDTA باعث تجمع پلاکتی گشته و ایجاد لخته های ریز را در نمونه می نماید.
-
اگر از ظروف Vacutainer استفاده میکنید برچسب روی ظروف موارد زیر را دارا باشند
-
ذکر نوع نمک EDTAومقدار آن
-
مقدار حجم خون مورد نیاز
-
تاریخ انقضا
-
وشرایط نگه داری
تری سدیم سیترات
تری سدیم سیترات با حذف کلسیم از ترکیب پروترومبیناز واکنش تبدیل پروترومبین به ترومبین رامتوقف میکند.در نتیجه تبدیل فیبرینوژن به فیبرین مهار خواهد شد.این واکنش با افزودن کلسیم به خون برگشت پذیر است.رایج ترین شکل مصرف آن نمک تری سدیم با وزن مولکولی294 (با دو مولکول آب)است.ترکیب سدیم سیترات و اسید سیتریک راسیترات سدیم بافری می گویند.این نوع از نوع غیر بافری ارجحتر است.
تاکید بر اهمیت غلظت صحیح سیترات به دلیل مشاهده اختلاف نتایج بین دو علظت 3.2% و 3.8% اسکولاریته 3.2 به اسمولاریته پلاسما نزدیک تر است. چون سیترات سدیم دارای غلظت کمتری است در مقادیر مختلف هماتوکریت نتایج آزمایش های انعقادی تغیرات کمتری نشان خواهد داد. سازندگان کیتهای PT میزان ISI را بر اساس 3.2 ارائه میدهند. بر اساس پیشنهاد NCCLS و ISTH غلظت مناسب 105-109یا به عبارتی 3.31-3.2 ( 3.2%)میباشد.
طرز تهیه سیترات
32گرم پودرتری سدیم سیترات با دو مولکول آب را در یک لیتر آب حل کرده به حجمهای 10 میلی لیتری تقسیم کنید سپس به مدت 15 دقیقه در 121 درجه اتو کلاو شود.این محلول در یخچال 4 درجه به مدت چندین ماه پایدار است و در صورت مشاهده کدورت و یا رشد کپک باید دور ریخته شود.
این ضد انعقادی را برای آزمایش های انعقادی باید به نسبت 1:9 (0.2سی سی خون و 1.8سی سی خون) به کار برد.برای برای اندازه گیری سرعت رسوب گلبول های قرمزٍٍESR) )از تری سدیم سیترات 0.2باید استفاده کرد .
برای محاسبه میزان ضد انعقاد دو روش وجود دارد.ابتدا هماتوکریت بیمار را بر روی محور افقی یافته وسپس بر اساس حجم نهایی مورد نظر (حجم خون +حجم ضد انعقاد)منحنی 1 یا 2 یا 5 یا 10 را انتخاب کرده و خطی عمودی از از مقدار هماتوکریت بیمار تا منحنی فوق رسم کنید.واز روی منحنی عمودی مقدار ضد انعقاد را بیابید .
روش دوم استفاده از فرمول است :
-
X=(100-PCV)/(595-PCV)
برای مثال اگر هماتوکریت بیمار 55 باشد
X=(100-55)/(595-55)=45/540=0.08
یعنی برای یک میلی لیتر خون ضد انعقاد باید 0.08می لیتر ضدانعقاد را به 0.92 می لیتر خون اضافه نمود
روش تهیه خون کنترل:
مواد کنترلی موادی هستند که در طول آزمایشهای روتین همراه با سایر نمونه ها مورد آزمایش قرار میگیرند و هدف استفاده از آن جهت ارزیابی قابلیت اطمینان بودن آزمایش ، خصوصا در رابطه با صحت و دقت است . مواد کنترلی باید پایدار و یکنواخت باشند ؛ خون کنترل از خون اسب یا انسان تهیه میشود ؛ در صورت استفاده از خون انسانی باید خون فاقد ویروس های HIV,HBs,HCV باشد.
انواع مواد کنترلی در هماتولوژی به سه دسته زیر بیان می شود :
-
Stabilize - Blood Control
-
LYSATE
-
HICN
وسائل مورد نیاز برای تهیه خون کنترل
-
ظروف شیشه ای استریل(ارلن بوخنر؛مزور؛پی پت ؛ظرف برای تقسیم؛آب مقطر استریل؛مگنت مغناطیسی )
-
آنتی بیوتیک : پنی سیلین و جنتامایسین 50-25میلیگرم برای cc500 خون
-
خون که باید کامل (whole Blood) و تازه (72-48 ساعته) باشد و ترجیحا o مثبت و از کیسه های انتقال خون (حاوی ضد انعقاد CPD یا ACD ) باشد .
مواد مورد نیاز
محلولها و مواد شیمیایی :
-
پودر تری سدیم سیترات 26 گرم
-
محلول فرمالدئید40-37% 75/6میلی لیتر
-
گلوتارآلدئید 50% 75/0میلی لیتر وتا 100 میلی لیتر به آن آب مقطر استریل می افزاییم
-
مقادیر بر اساس نیاز تهیه شود و محلول حاصل باید کاملا شفاف باشد. بهتر است که محلول تازه تهیه شود .
بعد از اماده کردن وسائل و همچنین محلولها ، ابتدا شاخص های مورد نظر را در دستگاه شمارشگر سلولی (CELL COUNTER) اندازه میگیریم.خون را از صافی 40 میکرون عبورمیدهیم و به ازای 50 حجم خون ، 1 حجم از معرف آماده شده می افزاییم.در ادامه ،آنتی بیوتیکها رامستقیما به خون اضافه میکنیم.مگنت را داخل ظرف حاوی خون انداخته و بمدت 2-1 ساعت با شیکر مغناطیسی مخلوط میکنی در آخر محلول را بمدت 24 ساعت در یخچال قرار میدهیم. ظرف حاوی خون را هر روز از یخچال در آورده تا به دما برسد. سپس بمدت یکساعت مجددا روی شیکر قرارمیدهیم.مقداری از آن را برداشته و هر روز میخوانیم تا زمانی که شاخص های آن ثابت شود.بعد از آن در شرایط بسیار استریل همزمان با شیکر کردن دائم در لوله های استریل تقسیم میکنیم .
روش های کنترل تیوب ها
کنترل دقت : ویالهای متعدد را در روزهای متوالی به شمارشگر سلولی میدهیم که دقت کار در تقسیم خون مشخص شود.
کنترل پایدار
-
جهت کنترل پایداری در بیرون یخچال : یک تیوب را در حرارت اتاق قرار میدهیم و هرنیم ساعت با شمارشگر سلولی میخوانیم تا پایداری آن در بیرون کنترل شود.
-
جهت پایداری ویالها پس از باز شدن در یخچال : دو تیوب ثابت را در روزهای متمادی بررسی میکنیم تا زمان پایداری ویالها مشخص شود.
کنترل آلودگی
برای کنترل تیوب ها ، بعد از گذشت یک هفته ، چند تیوب را برای کشت میکروبی انتخاب می کنیم . برای بررسی داده ها و کنترل آنها و همچنین گرفتن میانگین از شاخص های اندازه گیری شده از رایانه استفاده می کنیم
رنگ امیزی TRAP
رنگ امیزی TRAP یا " اسید فسفاتاز مقاوم به تارتارات " رنگ آمیزی اختصاصی است که برای تشخیص لوسمی Hair Cell استفاده می شود . این زائده های موئی در زیر میکرسکوپ به رنگ ارغوانی دیده می شوند . معمولا به صورت گرانول در اطراف سلول ها مشاهده می شوند .
-
این سلول ها دارای اسید فسفاتاز هستند که مقاوم در برابر تارتارات است .
روش رنگ امیزی TRAP
-
cc 12 گلوكار آلدئيد + cc 160 استن + cc 40 آب مقطر به عنوان فیکس کننده به لام اضافه و بعد از 1 دقیقه خشک می کنیم .
-
بقيه محلول رنگي mg 15-10 را در یک قطره دي فنيل فرمالید حل كرده سپس روي آن cc25 آب مقطر اضافه می کنیم cc.25 ديگر بافر استات با PH=5/2 روي آن اضافه مي كنيم. 35 میلیگرم Fasted violet , پودر را به آن اضافه و سپس از صافی می گذرانیم .
-
به ازای هر 9 سی سی، cc1 تارتارات 2/0 مول اضافه مي كنيم . λ 100 كلرومنگنز 10% اضافه کرده و لام ها را داخل جار به مدت 2-1 ساعت در 37 درجه مي گذاريم. بعد از گذشت این زمان لام ها را زیر آب جار می گذاریم . جهت رنگ امیزی زمینه هم می توانیم از رنگ هماتوکسین استفاده کنیم .
Tartrate-resistant acid phosphatase (TRAP) activity in three hairy cells
در این شکل فعالیت TRAP را در سه سلول موئی می بینید
Different smear shows varying degrees
of positive TRAP staining
نماش درجات مختلف فعالیت آنزیم ترپ در اسیمری دیگر
TRAP in bone marrow from a differentpatient. Neutrophils and lymphocytes are
negative
رنگ امیزی مغز استخوان . دقتکنید که نوتروفیل ها ولنفوسیت ها منفی هستند .
مورفولوژی گلبول های قرمز:
گلبول های قرمز نرمال . لنفوسیت کوچک در وسط میدان

موضوعات مرتبط: هماتولوژي
ادامه مطلب
گلبول قرمز:
زمینه میکروسکوپ پر از گلبول های بوده و گلبول های سفید در لابه لای آنها دیده می شود به صورت مقعر بوده و در زیر میکروسکوپ گرد دیده می شود بیشترین مقدار خون را تشکیل می دهند و فاقد هسته هستند.
گلبول های سفید:
در واکنش های ایمنی شرکت می کنند و به 2 دسته تقسیم می شوند:
1-آگرانولوسیت ها(گلبول های سفید تک هسته ای):فاقد گرانول یا رنگدانه می باشند و 2 نوع اند لنفوسیت ها و منوسیت ها.لنفوسیت ها مهم ترین گلبول ها از لحاظ دفاعی اند و هسته در آنها تقریبا تمام سیتوپلاسم را پر می کند.
1- مونوسیت، 2- نوتروفیل ، 3 -باند
اسمیر خون محیطی. دو مونوسیت ( مقابل فلش)یک نوتروفیل (1) ویک لنفوسیت کوچک (2 ) مشاهده می شوند.
اسمیر مغزاستخوان . دو مونوسیت (1) ویک نوتروفیل (2) دیده می شوند.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
پذیرش:
۱) مشخصات بیمار رابه دقت در دفتر پذیرش آزمایشگاه ثبت نمایید ( نام ، نام خانوادگی ، سن ، جنس
نام پزشک معالج ، تاریخ مراجعه ) .
۲) زمان تحویل جواب آزمایشات را برای بیمار توضیح دهید .
۳) در صورتی که انجام آزمایش نیاز به ناشتا بودن بیمار دارد ، در همان مرحله پذیرش از ناشتا بودن بیمار اطمینان حاصل نمایید .
۴) به طور عادی جهت جلو گیری از بروز خطا در نتیجه آزمایشات بیوشیمی خون بهتر است بیمار ناشتا باشد . بخصوص در مورد آزمایشاتی مثل قند ، تری گلیسرید ، کلسترول و اوره .( بطور معمول زمانی معادل 12 تا 14 ساعت را جهت ناشتا بودن در نظر می گیرند ) .
-
در مورد CPK و کراتینین ، بیمار حداقل 6 ساعت قبل از نمونه گیری از انجام هر گونه تزریق وفعالیت عضلانی خودداری نماید .
۶) نام و نام خانوادگی بیمار را به همراه آزمایشات در خواستی بر روی برچسب ثبت نمایید .
۷) جهت انجام آزمایش CBC از ویال حاوی EDTA استفاده نمایید .
۸) جهت انجام آزمایش ESR از لوله حاوی سیترات سدیم استفاده نمایید .
۹) جهت انجام آزمایشات بیوشمی و سرولوژی از لوله آزمایش بدون ماده نگهدارنده استفاده نمایید
۱۰) قبل از شروع به نمونه گیری از آماده بودن کلیه وسایل از قبیل گارو ، سرنگ یکبار مصرف ، پنبه ، الکل طبی ( 70تا 75 درجه ) اطمینان حاصل نمایید .
۱۱) باتوجه به نوع و تعداد آزمایشات از سرنگ مناسب (۲ و ۱۰ و ۵ سی سی ) استفاده نمایید .
-
نمونه گیری :
-
ورید بازو بهترین محل جهت نمونه گیری می باشد ، در صورتیکه به هر دلیل نتوان از ورید مذکور استفاده نمود میتوان از وریدهای پشت دست یامچ پا استفاده نمود ولی باید توجه داشته باشیم که استفاده از این وریدها همراه با درد بیشتری نسبت به وریدهای بازو می باشد .
-
جهت نمونه گیری ، پس از مشخص نمودن ورید مورد نظرو بستن گارو با پنبه الکل محل را بخوبی استریل نمایید .
-
سوزن را از جهتی که برش آن به سمت بالا باشد ، وارد رگ نمایید .
-
پس ازگرفتن خون به مقدار کافی ، گارو را باز نموده وسوزن را خارج می نماییم ، سپس محل را باپنبه الکلی محکم فشار می دهیم تا خون بند آمده واز بروز عوارضی از قبیل کبود شدن جای سوزن جلوگیری شود
-
باید سعی شود گارو بیش از یک دقیقه روی بازو بسته نشده باشد ، در غیر اینصورت 3- 2 درصد افزایش همو گلوبین ، هماتو کریت وشمارش گلبولهای قرمز را به دنبال خواهد داشت .
-
سوزن را از سرنگ جدا نموده وسپس خون را به آرامی از دیواره لوله آزمایش درون لوله بریزید .
-
در هنگام جدا نمودن سوزن از سرنگ احتیاط لازم را به عمل بیاورید که سوزن وارد دست شما نشود .
-
ویال CBCرا آرام وبا یک حرکت به شکل عدد 8 حرکت دهید تا خون با ماده ضد انعقاد مخلوط شود .
-
لوله ESR را نیز به آرامی تکان دهید تا خون با ماده ضدانعقاد مخلوط شود .

موضوعات مرتبط: هماتولوژي
ادامه مطلب
ساختمان پلاکتها
پلاکتها اجسام کروی یا بیضوی کوچکی هستند که از قطعه قطعه شدن
سیتوپلاسم سلولهای بزرگی به نام مگاکاریوسیت در مغز استخوان حاصل میشود.
پلاکتها فاقد هسته هستند و با وجود این چون در مهره داران پست سلولهای
هستهداری به نام ترومبوسیت معادل پلاکتها میباشند پلاکتها را ترومبوسیت
نیز مینامند. عمر متوسط پلاکتها ۸ الی ۱۱ روز است. هر پلاکت توسط غشایی
غنی از گلیکوپروتئین محصور شده و بررسیها بیانگر وجود آنتی ژنهای گروههای
خونی در غشای پلاکتها میباشد.
در نمونههای خونی رنگ آمیزی شده پلاکتها دارای یک ناحیه محیطی به رنگ آبی
روشن به نام هیالومر و یک ناحیه بنفش مرکزی به نام گرانولومر
میباشند.ناحیه هیالومر حاوی دستهای از میکروتوبولها در زیر غشا و تعدادی
میکروفیلامنت میباشد. اجزای اسکلت موجود در ناحیه هیالومر به تغییر شکل
پلاکت و ترشح محتویات گرانولهای آن کمک میکند. گرانولها حاوی یون کلسیم،
سروتونین، فیبرینوژن، فاکتور رشد مشتق از پلاکت و پروتئینهای دخیل در
انعقاد خون میباشند.
پلاکتها، اجزای کوچک مسطحی هستند که در خون وجود دارند و از بقیه
سلولهای خونی بسیار کوچک ترند. این ساختارها حاوی آنزیمهایی هستند که
باعث انعقاد خون میشوند و وظیفه اصلی آنها جلوگیری از خونریزی و خارج
شدن گلبولقرمز از داخل رگ است.
علامت Plt در آزمایش خون نشاندهنده تعداد پلاکتها در هر میلیلیتر مکعب خون است و عدد مربوط به آن معمولا بزرگ ترین عدد برگه آزمایش خون است.
غیر از کنترل انعقاد خون، از میزان پلاکت برای بررسی روند بهبود نارسایی مغز استخوان و بیماریهای خونی هم استفاده میشود.
مقادیر طبیعی : پلاکت بین ۱۵۰ هزار تا ۴۰۰ هزار در هر میلیمترمکعب خون برای بزرگسالان طبیعی است. در نوزادان این مقدار کمی بیشتر است.
محدوده خطر : پلاکت زیر ۵۰ هزار یا بیشتر از یک میلیون غیر طبیعی است و نیازمند توجه خاص است.
چه چیزهایی پلاکت را کاهش میدهد؟
بزرگ شدن طحال، خونریزی شدید و مصرف پلاکت، لوسمی یا سرطان خون، ترومبوسیتوپنی، انواع وراثتی کمبود پلاکت، انعقاد منتشر خون در داخل رگها، شیمیدرمانی بعد از سرطان، عفونت و نارسایی مغز استخوان باعث کاهش پلاکت میشوند. عدم تولید پلاکت میتواند به خاطر مشکلات استخوانی نیز باشد.
چه چیزهایی پلاکت را افزایش میدهد؟
بیماری آرتریت روماتویید، کمخونی فقر آهن، مشکلات بعد از برداشتن
طحال، بعضی سرطانها و بیماریهای ژنتیکی خاص باعث افزایش مقدار پلاکت
میشوند.
نکاتی در رابطه با پلاکت خون
- ورزش شدید و قدرتی باعث افزایش میزان پلاکت میشود.
- در هنگام قاعدگی مقدار پلاکت خون کمی کاهش پیدا میکند.
- قرصهای ضد بارداری باعث بالا رفتن مقدار پلاکت میشوند.
- داروی استامینوفن پلاکت را کاهش میدهد.
اجزای دیگر آزمایش خون
به غیر از اجزای اصلی آزمایش خون مثل مقدار پلاکت، گلبولسفید و قرمز، هموگلوبین، مقادیر دیگری مثل:
MCV یا mean corpuscular volume و
MCH یا mean corpuscular hemoglobin و
MCHC یا mean corpuscular hemoglobin concentration وجود دارند که همه مربوط به گلبولقرمز و اندازه و شکل و مقدار هموگلوبین آن هستند. مقادیر متفاوت هر کدام از این ها میتواند نشاندهنده ی نوع خاصی از کمخونی باشد.
چگونگی انجام آزمایش خون
آزمایش خون یکی از سادهترین روشهای آزمایشی است. با پیشرفت تکنولوژی و وجود دستگاههای جدید معمولا پس از چند دقیقه میتوان پاسخ این آزمایش را دریافت کرد.
برای انجام این آزمایش حدود ۵ تا ۷ میلیلیتر از خون وریدی (سیاهرگی) لازم است که معمولا آن را در یک لوله آزمایش که با ماده ضدانعقاد خون پوشیده شده است جمعآوری میکنند.
برای ترکیب شدن بهتر ماده ضدانعقاد با خون، موقع خونگیری و کمی بعد از آن، لوله را تکان میدهند. در طی انجام آزمایش باید از هر اتفاقی که موجب تخریب سلولهای خونی میشود جلوگیری کرد. بعد از انجام آزمایش باید مدتی روی محل خونگیری فشار آورد تا خون بند بیاید.
در موارد کمخونی شدید هم، خونگیری برای انجام آزمایش خون مشکلی ایجاد نمیکند. برای کسانی که از سوزن یا مشاهده ی خون ترس دارند، باید تمهیدات ویژه در نظر گرفت.
بهترین زمان برای انجام آزمایش خون صبح و در شرایط طبیعی بدن است.
استرس، فعالیت بدنی شدید و یا خونریزی حاد میتواند نتایج آزمایش را کمی
تغییر دهد.
عوامل موثر بر تعداد پلاکتها
تعداد پلاکتها در خون محیطی در روز زیاد و در شب کاهش مییابد؛ این امر
احتمالا به میزان کار و استراحت بستگی دارد. پس از کار سنگین بدنی تعداد
پلاکتها در خون انسان ۳ تا ۵ برابر بیشتر میشود.
منشا تشکیل پلاکتها
در مغز استخوان سلولهایی به نام سلولهای مادر یا ریشهای چند ظرفیتی وجود
دارد که دو نوع سلول از آنها جدا میشود. سلولهای رده لنفوئیدی که
لنفوسیتهای B و T را میسازد و سلولهای رده میلوئیدی که این سلولها از آن
جهت که در محیط کشت قادر به تشکیل کلنی هستند به نام واحدهای کلنی ساز
(CFU) شناخته میشوند و یک دسته از سلولهای کلنی ساز که رده مگاکاریوسیتی
را میسازد (CFU-Meg) در نهایت پلاکتها را بوجود میآورند.
عملکرد پلاکتهای خون
پلاکتهای خون در خونروش به سرعت شکسته شده و عاملهایی را که در انعقاد نقش
داشته و موادی را که باعث انقباض لخته میشوند به درون پلاسما آزاد
میکنند. از شکسته شدن پلاکتها مادهای به نام سروتونین (۵- هیدروکسی
تریپتامین) به خون آزاد میشود این ماده خاصیت انقباض رگی را دارد.
بنابراین پلاکتها نه فقط از طریق هموار کردن انعقاد خون بلکه از طریق
انقباض رگی نیز از خونروش جلوگیری میکنند.
خون چگونه منعقد میشود؟
انعقاد خون عملی است که برای جلوگیری از اتلاف خون در هنگام ایجاد زخم
صورت میگیرد. خون در محل بریدگی منعقد میشود و سدی را پدید میآورد که
مانع خروج خون میشود. حتی زمانی که خون در داخل بدن نیز از درون رگها
خارج شود، منعقد میشود. عمل انعقاد شامل تشکیل لخته است که از مایع خون
که در این حالت به آن سرم گفته میشود جدا میشود.
اولین اتفاقى که متعاقب آسیب رگ هاى بدن رخ مى دهد، انقباض این رگ ها ست.
انقباض عروق آسیب دیده و کم شدن قطر آنها باعث مى شود میزان خونریزى
بلافاصله متعاقب آسیب کاهش چشمگیرى پیدا کند. پلاکت ها سلول هاى بسیار
کوچک و بدون هسته اى هستند که به تعداد نسبتاً زیاد در خون وجود دارند و
همراه با خون در همه رگ هاى بدن گردش مى کنند. وجود پلاکت هاى سالم و
فعال، براى انعقاد خون به خصوص در آسیب سرخرگ هاى بدن که با خونریزى زیادى
همراه است، ضرورى است.
پلاکت ها در محل آسیب، مستقیماً به دیوار ه رگ ها مى چسبند. تجمع پلاکت ها
به تشکیل توده کوچکى مى انجامد که در صورت جزیى بودن آسیب، مى تواند جلوى
خونریزى را بگیرد، اتفاق مهم ترى که متعاقب اتصال پلاکت ها رخ مى دهد،
فعال شدن آنها و آزاد شدن موادى است که باعث پیشرفت مراحل بعدى انعقاد خون
مى شوند. تجمع پلاکت ها، باعث شکل گیرى ساختارى موسوم به میخ پلاکتى بر
روى منطقه آسیب دیده مى شود. این ساختار امکان قطع خونریزى هاى کوچک را در
مدت زمانى اندک و بدون درگیر شدن واکنش هاى پیچیده انعقادى، فراهم مى
آورد. پس از اتصال پلاکت ها به دیواره رگ، آزاد شدن یک سرى مواد از آنها
به همراه عملکرد فاکتور هایى که از بافت هاى آسیب دیده آزاد مى شوند،
واکنش هاى زنجیره اى رخ مى دهند که نتیجه آنها تبدیل مولکول محلول در آب
فیبرینوژن به یک پروتئین رشته اى غیرمحلول در آب به نام فیبرین است. رشته
هاى فیبرین به صورت متقاطع قرار گرفته و یک شبکه تورى مانند را پدید مى
آورند سلول هاى خون به خصوص گلبول هاى قرمز در این شبکه تورى گیر مى کنند
و آنچه در آخر کار به دست مى آید، همان لخته خون است که محل آسیب دیده رگ
را مى پوشاند.
براى تبدیل شدن فیبرینوژن به فیبرین، چندین واکنش یکى پس از دیگرى رخ مى
دهند. حداقل سیزده فاکتور براى تحقق انعقاد خون به طور طبیعى مورد نیاز
هستند. کمبود یا ناکارا بودن هر یک از آنها مى تواند به اختلال در لخته
شدن طبیعى خون بینجامد. به عنوان مثال هموفیلى A و B که دو بیمارى ارثى
خونریزى دهنده هستند، به ترتیب به علت کمبود فاکتور هاى هشت و نه رخ مى
دهند. هر چند مسیر واکنش هاى انعقاد خون پیچیده به نظر مى رسد، ولى همین
تعدد فاکتور هاى دخیل در این فرآیند، امکان تنظیم و کنترل آن را در سطوح
مختلف فراهم مى کند.
مکانیسم انعقاد
سیستم انعقاد خون با فعال شدن فاکتور XII یا VII و یا هر دو شروع میشود.
اما هنوز معلوم نیست که فعال کننده خود اینها چیست. اینها هم موجب فعال
شدن پروتئینی به نام ترومبین میگردند. تشکیل ترومبین یک حادثه بحرانی در
روند انعقاد خون تلقی میشود. ترومبین مستقیما قطعات پپتیدی را از
زنجیرههای آلفا و بتا مولکول فیبرینوژن میشکند و ایجاد منومرهای فیبرینی
میکند که متعاقبا به صورت یک لخته فیبرینی پلیمریک بسیار منظم
درمیآیند.به علاوه ترومبین به عنوان یک محرک فیزیولوژیک بسیار قوی برای
فعال شدن پلاکتها عمل میکند. پلاکتها در حضور یون کلسیم، پروترومبین را
به ترومبین تبدیل میکنند و همین باعث افزایش مقدار ترومبین و در نتیجه
شدت واکنشها میگردد. نقطه پایان این واکنشها ، ایجاد پلیمر فیبرین است که
هنوز قوام کمی دارد اما برهمکنشهای الکتروستاتیک ما بین مولکولهای منومر
فیبرین مجاور ، باعث استحکام آن می شود.
پایدار شدن نهایی لخته خون با فعال شدن فاکتور XIII یا همان فاکتور پایدار
کننده فیبرین صورت میگیرد که شامل ایجاد پیوند کووالانسی ما بین اسید
آمینههای لیزین با گلوتامین بین زنجیرهای آلفا و Y مجاور هم در مولکولهای
فیبرین میباشد. نیز فاکتور XIII میتواند یک مهار کننده فیزیولوژیک
فیبرینولیز را به لخته فیبرین با پیوند کووالانسی متصل میکند و در نتیجه
لخته مربوطه در مقابل اثر لیزکنندگی پلاسمین حساسیت کمتری خواهد داشت.
چنانچه در طی تشکیل لخته ، پلاکت باشد، لخته ایجاد شده کاملا جمع یا منقبض
میشود و علت آن انقباض یک پروتئین پلاکتی است.
مهار کنندههای طبیعی انعقاد
آنتی ترومبین III :با ترومبین به صورت یک به یک جمع شده و آن را از فعالیت باز میدارد.
کو فاکتور II هپارین: این نیز به عنوان مهار کننده ترومبین میباشد، کمبود ارثی این ، میتواند موجب ترامبوز شود.
آلفا ماکروگلوبین: از جنس گلیکوپروتئین است و ترومبین را از فعالیت باز میدارد.
پروتئین C:وجود نیاز به ویتامین K دارد که بوسیله ترومبین فعال شده و موجب انعقاد میشود.
پروتئین S:به عنوان کوفاکتور همراه پروتئین C عمل میکند و برای وجودش ، نیاز به ویتامین K است.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
|
در خون قندهای مختلف وجود دارند که همه آنها را تحت عنوان کربوهیدراتها مینامند. از این اینها قنداهای کربنی گلوکز را به علت تشکیل بخش اعظم این کربوهیدرات و اینکه همه این کربوهیدراتها در آخر به این قند تبدیل میشوند به عنوان قند خون تعریف میکنند. |
مفاهیم کلی
در شرایط طبیعی غلظت گلوکز خون در محدوده باریکی ، معمولا بین 90 - 80 میلیگرم در دسی لیتر هر روز صبح قبل از صرف صبحانه در شخص ناشتا کنترل میشود. این غلظت در حدود ساعت اول بعد از صرف یک وعده غذا به 140 - 120 میلیگرم در دسی لیتر خون افزایش مییابد. اما سیستمهای فیدبکی برای کنترل گلوگز خون غلظت گلوکز را به سرعت (معمولا در ظرف 2 ساعت بعد از آخرین جذب کربوهیدراتها) به حد طبیعی باز میگردانند. بر عکس ، در حالت بیغذایی ، بوسیله گلوکونئوژنز در کبد گلوکز مورد نیاز برای حفظ غلظت گلوکز در حد ناشتا را تامین میکند. این مقادیر برای بیماران دیابتی قدری بالاتر است.
کنترل سطح قند خون
1. کبد به عنوان یک سیستم بافری مهم برای گلوکز خون عمل میکند به این معنی که هنگامی که گلوکز خون به دنبال صرف یک وعده غذا تا غلظت زیادی بالا میرود میزان ترشح انسولین نیز افزایش مییابد و در حدود 3/2 گلوکز جذب شده از روده بلافاصله به گلیکوژن تبدیل شده و در کبد ذخیره میشود. در طی ساعات بعد که غلظت گلوکز خون و نیز در این ترشح انسولین کاهش مییابد، کبد گلیکوژن را تجزیه و به گلوکز تبدیل میکند. این تنظیم در بیماران با اختلالات کبدی تقریبا غیر ممکن است.
2. علاوه بر انسولین ، گلوکاگون نیز در تنظیم مقدار قند خون دخیل است. این هورمون بر عکس انسولین کار میکند. بطوری که با کاهش گلوکز خون ترشح گلوکاگون افزایش مییابد و برعکس انسولین ، موجب تجزیه گلیکوژن و به سطح نرمال رساندن غلظت گلوکز میشود.
3. یک اثر مستقیم کاهش غلظت گلوکز خون تحریک غده هیپوتالاموس و سیستم عصبی سمپاتیک میباشد که موجب ترشح اپی نفرین از غدد فوق کلیوی میگردد. اپی نفرین بر روی کبد اثر کرده و موجب آزاد سازی گلوکز میشود.
4. دو هورمون رشد و کورتیزول نیز در این تنظیم موثرند چرا که مقدار مصرف را بوسیله قسمت اعظم سلولهای بدن کاهش میدهند و بجای آن ، گلوکز را به چربی تبدیل میکنند.
اهمیت کنترل سطح قند خون
چرا حفظ یک غلظت ثابت گلوکز ، اهمیت دارد در حالی که بیشتر بافتها میتوانند در غیاب گلوکز از چربیها و پروتئینها استفاده کنند؟ پاسخ این است که گلوکز تنها ماده غذایی است که بوسیله مغز ، شبکیه ، اپیتلیوم زایای غدد جنسی استفاده میشود و بنابراین حفظ غلظت گلوکز خون ، ضروری میباشد. به خاطر همین قسمت اعظم گلوکزی که در مرحله بین غذاها از طریق گلوکونئوژنز (ساخت گلوکز از مواد دیگری مثل پروتئینها و چربیها) تشکیل میشود.
اهمیت بالا نرفتن سطح گلوکز خون
· گلوکز مقدار زیادی فشار اسمزی در مایع خارج سلولی اعمال میکند اگر مقدارش افزایش یابد فشار اسمزی خارج سلول هم افزایش مییابد و همین موجب بهم خوردن قدرت ترابری غشای سیتوپلاسمی گردیده و همین خود به نتایج ناخوشایندی چون ادم ، از دست دادن آب سلول و ... میگردد.
· گلوکز زیادی از طریق ادرار دفع میگردد و همراه این مایعات و الکترولیتهای بدن نیز تخلیه میشود.
· افزایش دراز مدت سطح گلوکز خون ، موجب آسیب بسیاری از بافتها و بویژه رگهای خونی آنها میگردد و همین ممکن است به نتایجی چون حمله قلبی ، سکته مغزی ، بیماریهای کلیوی گردد.
دیابت اولین بیماری حاصل سم خوردگی سطح نرمال غلظت گلوکز
دیابت قندی ، یک سندرم اختلال متابولیسم کربوهیدرات ، چربی و پروتئین است که توسط یا فقدان ترشح انسولین یا کاهش حساسیت بافتها به انسولین بوجود میآید. به دو نوع دیده می شود: وابسته به انسولین که بر اثر فقدان انسولین میباشد و غیر وابسته به انسولین ، بر اثر کاهش حساسیت بافتهای هدف به انسولین بوجود میآید. به این دومی ، مقاوم به انسولین هم میگویند.
این بیماری سوخت و ساز گلوکز را در همه انواع سلولها به غیر از سلولهای مغز را دگرگون میکند. از علایم دیابت به موارد مقابل میتوان اشاره کرد: تشنگی بیش از حد ، ادرار کردن زیاد ، خارش بدن ، خستگی ، گزگز دستها و پاها ، کاهش وزن و ایجاد زخمهایی در پاها که به راحتی التیام نمیپذیرند. اما در نوع دوم (مقاوم به انسولین) چاقی دیده میشود و بنابراین اینها نیاز به رژیم غذایی مناسبی دارند.
هیپوگلیسمی یا شوک انسولین
افراد دیابتی که جهت درمان و کنترل بیماری خود از قرصهای پایین آورنده قند استفاده میکنند در بعضی مواقع خونشان بطور غیر عادی کاهش مییابد. این حالت ممکن است در عدم مصرف قرص هم دیده شود. در این حالت مقدار قند خون به پایینتر از 60 میلیگرم نزول میکند. شایعترین علت ، بینظمی در ساعات غذا یا فراموش کردن یکی از نوبتهای غذایی است. چرا که باید بین برنامه غذایی ، انسولین موجود و ورزش تعادل باشد. ممکن است کاهش قند خون به دلیل کاهش وزن باشد چرا که با کاهش وزن ، مقاومت انسولینی هم کاهش و همین موجب کاهش قند خون میگردد.
از علایم کاهش قند خون میتوان به موارد زیر اشاره کرد: گرسنگی ، لرز ، عصبانیت ، تعریق ، سرگیجه ، ضعف ، تحریک پذیری و تپش قلب و در موارد حادتر فریاد کشیدن، چشم ، خواب آلودگی ، سردرگمی ، عدم تعادل در راه رفتن، تاری دید و سر درد. در این مواقع از غذاهای نشاستهای سریعالاثر مثل چند حبه قند ، دو یا سه قاشق مرباخوری شکر ، آب پرتقال (نصف لیوان) ، چند تکه میوه خشک شده ، محلول رقیق قندی و شربتها ، باید استفاده کرد.
نقش هموگلوبین در تعیین سطح خون
گلوکز 6- فسفات و سایر قندها به صورت برگشت پذیری با هموگلوبین واکنش نشان میدهند بنابراین میتوان گفت مقدار ساخت گلبول قرمز و نیز سطح قند خون باهم متناسب است. به خاطر همین ، افراد دیابتی در مقایسه با افراد سالم ، مقدار بالایی از هموگلوبین (از نوع A1c) را دارند. بنابراین اندازهگیری سطح هموگلوبین هر چند هفته یکبار میتواند در تعیین اینکه آیا سطح گلوکز بیماران دیابتی به حد کافی کنترل شده است یا نه؟ بسیار مفید باشد.
مقدار گلوکز و روابط با دیگر ترکیبات بدن
میزان انرژی مورد نیاز در طول 24 ساعت از 1600 کیلوکالری در حالت استراحت تا 6000 کیلوکالری بسته به شدت فعالیت تغییر میکند. و مقدار ذخایر سوختی یک فرد 70 کیلویی ، معادل 1600 کیلوکالری گلیکوژن ، 24000 کیلو کالری از پروتئین ، 35000 کیلو کالری تری اسیل گلیسرول میباشد. بنابراین ، مقدار مواد سوختی این فرد ، نیازهایش را برای 1 الی 3 ماه گرسنگی تامین میکند. اما ذخایر گلوسیدی بدن ، در عرض یک روز به مصرف میرسد.
و سریعا مقدارش افت پیدا کرده و نیاز به تامین مجدد دارد. اسیدهای چرب نمیتوانند به گلوکز تبدیل شوند البته قسمت گلیسرول ساختمان تری اسیل گلیسرولها ، میتواند به گلوکز تبدیل گردد، اما مقدار گلیسرول کم است یک منبع عمده دیگر برای گلوکز ، اسیدهای آمینه است که از تجزیه پروتئینها مشتق میگردد. در طول گرسنگی ، عضله ، بزرگترین منبع اسیدهای آمینه بشمار میرود.
چشم انداز بحث
با در نظر تغذیه و ورزشهای منظم ، احتمال یک سری از اختلالات قند خون که با زمینه ارثی میباشند وجود دارد. بنابراین برای پیشگیری ، رعایت کلیه موارد (ژنتیکی و محیطی) ضروری میباشد. امروزه با روشهای مهندسی ژنتیک ، توانستهاند راه حلهایی برای حل دیابت با زمینه ارثی ، فراهم نمایند.
موضوعات مرتبط: هماتولوژي
ESRیکی از تستهای رایج در آزمایشگاه های تشخیص طبی میباشد که بنا به درخواست پزشک برای بسیاری از بیماران انجام میشود. این تست یک تست ارزان قیمت و البته غیر اختصاصی میباشد که نتایج آن همراه با نتایج سایر تستها ارزشمند و کمک کننده میباشد. ESR تحت شرایطی مانند بیماری های اتو ایمیون به ویژه روماتیسم مفصلی، در عفونتها، التهابات حاد و مزمن و سرطانها افزایش میابد بنابراین با تنها افزایش میزان رسوب گلبولهای قرمز به تشخیص دقیقی نمیتوان دست یافت.سرعت رسوب گبولهای قرمز خون بر حسب میلیمتر بر ساعت میباشد. در این تست خون گرفته شده همراه با ضد انعقاد سیترات سدیم در لوله های بلند و باریکی کشیده شده و به صورت عمودی روی پایه های سدیمان قرار داده میشود. پیپت های ESR پیپت های بلندی هستند که از قسمت سر به انتها از ۰ درجه بندی شده اند. خون داخل پیپت ها تا عدد ۰ کشیده شده و بعد از طی ۱ ساعت میزان رسوب گلبولها از عدد ۰ تا جایی که پلاسما شفاف وجود دارد خوانده میشود
.
موارد درخواست تست:
این تست در موارد مشاهده علائمی مبنی بر التهابات و یا بدخیمی ها و همچنین علائم مربوط به رماتیسم مفصلی مانند درد و ورم مفاصل در خواست میشود. لازم به ذکر است که با توجه به غیر اختصاصی بودن این تست حتما همراه با سایر تستهای ارزشمند و کمک کننده به تشخیص نهایی مانند الکتروفورز پروتئینهای سرم، اندازه گیری فیبرینوژن و ... بنا به علائم بیمار درخواست میشود. همچنین بعد از تشخیص بیماری این تست به منظور ارزیابی میزان پاسخ به درمان در فرد بیمار به صورت دوره ای درخواست میشود. کاهش ESR از مقدار قبلی نشانه از بهبودی و افزایش مجدد آن نشانه ای از عود بیماری میباشد.مقدار نرمال ESR در مردان تا ۱۰ و در زنان تا ۲۰ میلیمتر بر ساعت میباشد.
موارد افزایش سدیمان :
افزایش ESR نشانه ای از افزایش گلبولینها و یا فیبرینوژن پلاسما بوده و نیاز به بررسی های بیشتری دارد.
۱- افزایش خفیف در التهابات خفیف و جزئی، حاملگی و آنمی. در آنمی ها به دلیل اینکه میزان گلبولهای قرمز کم میشود دافعه بین این سلولها کمتر از حالت عادی شده و بنابراین میزان رسوب افزایش میابد حال اینکه در پلی سیتمی به دلیل افزایش در تعداد اریتروسیتها دافعه بین سلولی بیشتر شده و این امر باعث کاهش رسوب و کاهش ESR میگردد.
۲- افزایش شدید این تست میتواند بیانگر افزایش در پروتئین های خون از جمله گلبولینها باشد. افزایش گلبولینها در مواردی مانند عفونتها، مولتیپل میلوما، ماکروگلبولنمی والدنشتروم ( در این مورد حتی در غیاب التهاب افزایش ESR باز هم دیده میشود.) و رماتیسم مفصلی دیده میشود.
۳-در زنان معمولا میل به افزایش در ESR بیشتر بوده و در دوران قاعدگی و بارداری میزان آن افزایش میابد.
۴- داروها شامل دکستران، متیل دوپا، تئوفیلین، پنیسیلین پروکاینامید و داروهای پیشگیری از بارداری خوراکی باعث افزایش ESR میگردند.
*کاهش ESR معمولا حالت مهمی نبوده و گاهی در موارد پلی سیتمی، لکوسیتوز و ناهنجاری گلبولهای قرمز مانند سیکل سل دیده میشود. همچنین داروهایی مانند آسپیرین، کورتیزون و کینیون باعث کاهش ESR میگردند.
موضوعات مرتبط: هماتولوژي
ادامه مطلب
.: Weblog Themes By Pichak :.