
ســــــــــــــــــــــــــــــــــــــــــــــــــــلامی
به گــــــــــــرمی نـــــــــــــفسهاتون..
محسن
فوق لیسانس مدیکال مایکولوژی
و ســـــــــــــاکن شهر تهـــــــــــــــــران
هـــــــــــــــــــــــــــــــــــــــــــــستم.
امیــــــــــــــــــــــــــــــــــــدوارم که
لحظـــــــــــــــــات خـــــــــوب و خوشی
را در وبـــــــلاگم سپـــــــــــــــری نمایید.
.
.
1388 دانشگاه علوم پزشکی قم - کارشناسی
1393 دانشگاه علوم پزشکی اصفهان - کارشناسی ارشد
........(_\.........
.../_)...) \........
../ (....(__)......
.(__)...oooO....
Oooo..............
.
گفتم غم تو دارم گفتا غمت سر آید گفتم که ماه من شو گفتا اگر برآید
گفتم ز مهرورزان رسم وفا بیاموز گفتا ز خوب رویان این کار کمتر آید
گفتم که بر خیالت راه نظر ببندم گفتا که شبرو است او، از راه دیگر آید
گفتم که بوی زلفت گمراه عالمم کرد گفتا اگر بدانی هم اوت رهبر آید
گفتم خوشا هوایی کز باد صبح خیزد گفتا خنک نسیمی کز کوی دلبر آید
گفتم که نوش لعلت ما را به آرزو کشت گفتا تو بندگی کن کو بنده پرور آید
گفتم دل رحیمت کی عزم صلح دارد گفتا مگوی با کس تا وقت آن درآید
گفتم زمان عشرت دیدی که چون سر آمد گفتا خموش حافظ کاین غصه هم سر آید
آمیلوئیدوز بیماری نادری است و هنگامی رخ می دهد که یک پروتئین غیر طبیعی به نام آمیلوئید در اندام های شما تجمع یافته و عملکرد طبیعی آنها را مختل کند. آمیلوئید به طور طبیعی در بدن یافت نمی شود اما می تواند از چندین نوع مختلف پروتئین تشکیل شود. ارگان هایی که ممکن است به آن مبتلا شوند شامل قلب، کلیه ها، کبد، طحال، سیستم عصبی و دستگاه گوارش است.
برخی از انواع آمیلوئیدوز در ارتباط با سایر بیماری ها رخ می دهد. این نوع با درمان بیماری زمینه ای ممکن است بهبود یابد. برخی از انواع آمیلوئیدوز حتی ممکن است منجر به نارسایی اندام شود. همراه کافه پزشکی باشید
درمانها ممکن است شامل شیمی درمانی، مشابه آنچه در مبارزه با سرطان استفاده می شود باشد. پزشک شما ممکن است داروهایی را برای کاهش تولید آمیلوئید و کنترل علائم پیشنهاد کند. برخی افراد ممکن است از پیوند عضو یا سلول های بنیادی بهره مند شوند.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
مراحل PCR به طور خلاصه
۱- denaturation حرارت دادن برای جداسازشدن دو رشته DNA در یک دقیقه
۲- anealing یا چسبیدن آغاز گر ( اتصال پرایمر به هدف ۹ دمای ۴۰ـ ۶۰ که در این مرحله مقدار دما بستگی به توالیهای بازی پرایمر های مکمل توالی رشته DNA دارد آغاز گر ها ، در دمایی که مانع اتصال غیر اختصاص آنها می شود . مساوی ۵۰% باشد این دما ۵۵ و اگر بیشتر باشد درجه حرارت اتصال برابر ۶۰ است . زیرا c و g دارای ۳ پیوند هستند .
۳- polymerization گسترش رشته DNA : در این مرحله DNA پلیمراز شروع به همانند سازی می کند . و طویل شدن رشته مکمل ازOH اغازگر شروع می شود . در این واکنش از DNA پلیمراز مخصوص که در برابر حرارت مقاوم است به نام tag DNA polimerase استفاده می گردد . این انزیم در دمای ۹۴ کاملا پایدار است ودمای اپیتم عمل آن ۷۲ c است .
۴- تکرار این مراحل تا چند سیکل که در نتیجه مقدار قابل توجهی DNA سنتز شود . تکثیر DNA پس از چسبیدن اغازگر به انتهای ۵ توالی های مشخص از DNA الگو صورت می گیرد تکرار مراحل باز شدن دو رشته dna با چسبیدن اغازگر و طریل شدن ان را یک سیکل پی سی ار می نامند .
۵- پس از یک سیکل pcr از یک مولکول DNA دو مولکول و پس از سیکل دوم چهار مولکول و پس از ۲۰ مولکول DNA وجوددارد این عمل را می توان با استفاده از دستگاه اتوماتیک ترمال سایکلر که قابل برنامه ریزی است به اسانی انجام می گردد .
۶- تعداد چرخه ها یا سیکلها بستگی به کیفیت واکنش و مقدار DNA الگو در واکنش دارد ولی عموما بین ۲۵ـ۳۵ و معمولا ۳۰ است با افزایش تعداد سیکلها باندهای ناخواسته افزایش می یابد .
مواد لازم PCR
۱- بافر PCR: شرایط یونی PH مناسب را برای واکنش PCR فراهم می کند
نکته : بافر به صورت x10 ساخته می گردد . این بافر شامل موادی با غلظت های زیر می باشد . دارای گلیسیرول برای سنگینی کار و دارای رنگ برای مشهود سازی DNAدارد .
۲- دزوکسی نوکلئوتید تری فسفات
که به صورت مخلوطی از چهار باز A-T-C-G در بازار وجوددارد تا کنار هم چیده شوند . و رشته مکمل را ایجاد کنند .
۳- اغازگرها primer : پرایمرها قطعات سنتز شده ای از بازهای آلی اند که بر اساس قطعه ای مورد نظر الگوهای هدف ساخته می شوند . که معمولا با طول ۱۵ـ۳۰ نوکلئوتیدهستند که به DNA الگو متصل می شوند و دارای انتهای ۳oh آزاد هستند .
طول پرایمرها بسیار مهم است هر چه طول پرایمر بلند باشد اختصاصی تر عمل می کند برای تعیین طول مناسب می توان از رابطه ( تعداد بازها در ژنوم هدف ۴٫۴٫۴…..>x2 ) استفاده کرد . که n برابر تعداد بازهای مناسب برای اغازگر می باشد .
این دو پرایمر دو عمل انجام می دهند . اول این که محل ژنی که باید تکثیر شود را مشخص می نمایند و دوم این که اندازه قطعات تکثیر شونده را تعیین می کنند .
باید توجه داشت دو پرایمر دارای نقطه ذوب نزدیک به هم باشند پرایمر مورد نظر توسط کامپیوتر انتخاب می گردد .
۴- tag DNA polymerase: یک انزیم مقاوم به دما است که همانند سازی DNA را انجام می دهد این انزیم از باکترtremmus aquaticus بدست آمده است جهت سنتز DNAهمیشه از ۳ـ ۵ می باشد و همه انزیمها برای شروع فعالیت سنتز DNA را انجام می دهد . که توسط قطعات کوتاه آغازگر ها تامین می گردد. در واقع این انزیم غلط گیری می کند . تا قبل از کشف آنزیم tag از انزیمw kleno استفاده می شد . آنزیم tag پلیمراز باعث شد به راحتی واکنش PCR به ورت اتوماتیک انجام شود . و با افزودن یکبار انزیم افزایش حساسیت و دقت PCR است .
۵) آب برای نهایی کردن O2H.Dکه باید کل ان حجم ۵۰ml یا ۲۵ml باشد .
۶ـ mgcl2 کلرید منیزیم نقش کوفاکتوری در فعالیت آنزیم tag دارد .
اثر متقابل رشته dna الگو و آغازگر را افزایش می دهد . غلظت کلریدمنیزیم اثر زیادی برروی اختصاصی شدن و نهایتا بازده واکنش PCRدارد .
غلظت زیاد ان اثر بازدارندگی برروی فعالیت آنرزیم تک دی ان آپلی مراز دارد و مقدار محصول نهایی را کاهش می دهد رابطه مستقیمی بین افزایش غلظت dntps و mgcl در محلول واکنش وجوددارد و مقدار مناسب ان باید به طور عملی در آزمایشگاه بدست آید .
۷ـ دی ان آ الگو tempate DNA :
بستر به هدف ازمایش از منابع موردنیاز با استفاده از یکی از روشهای مرسوم استخراج می شود . معمولا به ازای هر واکنش ۵% واحد یا ۱% میکرو لیتر استفاده می شود .
۸ـ لوله های واکنش : لوله های کوچک ۵% میلی لیتر
۹- سمپلریا میکرو پیست و سر سمپلرهای یکبار مصرف مخصوص انها کهرای برداشتن مقادیر بسیار کم استفاده می گردد .
۱۰- دستگاه چرخش حرارتی
۱۱- میکرو فیوژ
۱۲- روغن معدنی mineraloil : یک قطره روی مخلوط واکنش اضافه می شود تا از تبخیر نمونه در دستگاه چرخش حرارتی thermal cycler جلوگیری می شود . معمولا ۵۰ ـ ۶۰ میکرولیتر به حلول واکنش ۱۰۰ میکرولیتری اضافه می شود .
ضمنا باید توجه داشت که مواد قابل اتوکلاو استریل شوند . البته dntp پرایمرهاو آنزیم tag را نمی توان اتو کلاو کرد .
بازدارنده ها و افزاینده های فعالیت PCR:
۱- مواد موجود در نمونه های متفاوت موجودات زنده مانند وجود ترکیبات فنلی و غیره که باید با انتخاب صحیح روش استخراج از محلول DNA جداشود .
۲- شوینده های موجود در بافر استخراج : در مراحل استخراج DNA از شوینده های غیر یونی مانند tritonx و twen و… استفاده می شود . که برروی PCR اثر باز دارندگی ندارند ولی شوینده های یونی مثل sds (سدیم دودسیل سولفات ) فقط به مقدار کم در محلول قابل تحمل می باشد . بنابراین با استفاده از فنل و یا شستشو با الکل باید این مواد را از DNA جداکرد . مقدار ۱% از ان برای پی سی ار عامل بازدارنده محسوب می شود .
۳- آنزیم پروتئیناز k که در مراحل استخراج DNA همراه با مواد شوینده برای هضم پوتئین استفاده می شود . به عنوان بازدارنده فعالیت PCR می باشد . زیرا انزیم tag نسبت به انزیم حساس می باشد . و این انزیم cDk باید حذف یا غیر فعال شود . با تیمار گرمایی می توان سبب غیر فعال شدن این انزیم شد که در این صورت بایستی بعد از تلخیص DNAبافنل و کلروفوم ان را هم سانتریوفوژ نمود که در این صورت باقیمانده پروتئیناز k به داخل فاز فنلی وارد شده و DNA در فاز مایع باقی می ماند .
۴- باقیمانده فنلی : فنل نیز بایستی از محیط خارج شود زیرا بازدارندگی بر فعالیت انزیم tag DNA polymerase دارد . که به این منظور پس از استفاده از فنل و کلروفرم از ایزو پروپانول استفاده کرد .
افزاینده های فعالیت PCR:
ماده و غلظت
فورمامید ۵%
دی متیل سولفوکسید کمتر از ۱۰%
تترامتیل امونیوم کلراید ۱۰۰ – ۱۰ %
پلیاتیلن گلیکول ۶۰۰۰ ۵% ـ ۱۵
گلیسرول ۱۰%- ۱۵
توین۲۰ ۵/۲ – ۱/۰ %
پروتکل PCRمعمولی
|
مقدار حجمی (میکرولیتر) |
غلظت نهایی |
ماده |
|
۵/۲ ۱ ۰٫۵ ۱ ۱ ۱/۰ ۳ متغیر |
x1 ۲M m ۲۰۰Mm ۲/۰ـ۱ Mm ۲/۰ـ۱ Mm ۵/۰u ۰٫۵-۱Mg ـ |
بافر۱۰m ۵۰mMMgcl2 ۱۰mndntp اغازگر۱ آغازگر ۲ پلیمرازDNA tag DNAالگو آب مقطر استریل |
حجم نهایی واکنش PCR که انجام خواهید داد ۲۵ Ml باشد تمام اجزاء فوق بجز DNA الگو ابتدا دریک لوله mix به تعداد لوله های تهیه و سپس بین لوله ها تقسیم می شود . و پس یک لوله شاهد مثبت و یک لوله شاهد منفی نیز باید داشته باشد لوله شاهد مثبت حاوی DNA الگویی است که قبلا کارایی ان در واکنش pcr تایید شده است لوله شاهد منفی بدون الگو می باشد بعد از اضافه کردن تمام محلولهای یک قطره روغن معدنی برای جلوگیری از تبخیر به ان اضافه نموده و پس لوله ها را در دستگاه pcr قرار دهید .
درجه حرارت وزمان مناسب برای دستگاه :
سیکل اول :
۱- سه دقیقه ۹۲ـ۹۴ واسرشت کردن
۲- ۵۰ ثانیه ۵۰ –۶۰ اتصال آغازگرها
۳- ۱ دقیقهDNAسازی
سیکل بعدی
۱- ۴۵-ثانیه ۹۲ـ۹۴ واسرشت کردن
۲-۵۰ ثانیه ۵۰- ۶۰ اتصال اغازگرها
۳-۱دقیقه DNAسازی
سیکل آخر
۱ـ۴۵ ثانیه ۹۲ـ ۹۴ واسرشت کردن
۲ـ۵۰ ثانیه ۵۰ –۶۰ اتصال اغازگرها
۳ـ۴-۱۰ دقیقه DNA سازی
موضوعات مرتبط: ايمونولوژي

بیماری بهجت(Behcet) بیماری شایع روماتیسمی در ایران بیماری بهجت یک گونه کارکرد نادرست التهابی چند سیستمی و مزمن هست ؛ علت آن هنوز به درستی شناخته نشده ولی واسکولیت یافته ی آسیب شناسی آن هست و آسیب عصبی در این بیماری اگرچه گاهگاهی دیده می شود ولی مهم هست ؛ این بیماری نخستین بار در سال 1937 به وسیله دکتر هولوسی بهجت از ترکیه گزارش شد .



تاریخچه
نام این سندرم برگرفته از نام متخصص پوست ترک به نام Hulusi Behçet می باشد که در سال 1937 به بیان این سندرم پرداخت . وی به بیان علائم زخم های دهانی، زخم های ناحیه ژنیتال، التهاب داخل چشمی که منجر به کوری می شود را از خصوصیات این سندرم بیان نمود .
تعریف
بهجت یک بیماری مزمن است که به علت اختلال در سیستم ایمنی بوجود می آید. سیستم ایمنی بطور نرمال بدن را در مقابل عفونت ها از طریق کنترل التهاب مصون می دارد. در بیماری بهجت سیستم ایمنی بصورت غیر قابل پیش بینی شروع به تولید بیش از حد و در نتیجه طغیان مواد التهاب زا می نماید. این التهاب بیش از حد بر روی رگهای خونی علی الخصوص رگهای بسیار کوچک تاثیر گذاشته و در نتیجه نشانه های آن در هر جایی که ذخایر خونی وجود داشته باشد بصورت لکه های ملتهب ظاهر می شود.
علت
با وجود تمام مطالعات انجام گرفته هنوز عوامل اصلی ایجاد بیماری به طور کامل شناخته نشده اند، نمی توان بروز این سندرم را بخاطر ابتلا به برخی از عفونتها نیز قلمداد کرد . بطور قطع نیز نمی توان بروز این سندرم را ژنتیکی نامید اما در سالهای اخیر عده ای از محققان آلوده سازهای محیطی و فاکتورهای ژنتیکی را با وقوع این سندرم مرتبط دانسته اند.
از سوی دیگر برخی تحقیقات نشان داده که ممکن است بیماری ریشه فامیلی داشته باشد؛ یعنی در تعدادی از افراد عضو یک فامیل دیده شود و با ژنهای خاصی ارتباط داشته باشد. با این حال برخی تحقیقات پی به وجود تاثیر آلرژیهای غذایی علی الخصوص محصولات لبنیاتی در بروز این سندرم برده اند .

علائم
از آنجا که تظاهرات دهانی بهجت تقریبا مشابه زخمهای آفتی است. ممکن است در ابتدا با یک آفت ساده اشتباه شود. به همین دلیل، نمی توان تنها با استناد به علائم دهانی بیماری را تشخیص داد.
زخمهای دهانی بهجت معمولا دردناک و سطحی یا عمقی هستند و به صورت منفرد یا خوشه ای در هر نقطه از دهان ظاهر می شوند. این زخمها به مدت یک تا 2 هفته پایدار می مانند و بعد بدون این که از خود اثری باقی بگذارند، محو می شوند.ابتلای پوستی ممکن است جوشهایی مشابه جوشهای غرور جوانی ایجاد کند. شاید بدترین عارضه بهجت مربوط به چشمها باشد، چرا که بسرعت پیشرفت می کند و گاهی حتی به کوری منتهی می شود. علایم چشمی یا از شروع بیماری وجود دارد یا طی مراحل بعدی رخ می دهد و در نهایت ملتحمه شبکیه و حتیجسم مژگانی را درگیر می سازد.
اصولا آنچه باعث بروز علایم این سندرم است، واسکولیت یا همان تخریب عروق کوچک و متوسط است. این تخریب در نهایت موجب از بین رفتن فعالیت ارگان مورد نظر می شود. یکی دیگر از نشانه های بهجت، آرتریت یا التهاب مفاصل است که این آرتریت غالبا زانو و مچ پا را درگیر می کند. اما برخلاف سایر آرتروزها در دست و پا تغییر شکلی ایجاد نمی کند. در عده ای از بیماران ممکن است درگیری اعصاب مرکزی یا گوارش هم دیده شود که البته خیلی شایع نیست. migna.ir

در حال حاضر تست تشخیصی خاصی برای این سندرم وجود ندارد. تشخیص این سندرم بالینی بوده و از روی الگوی خاص علائم تکرا علائم مشخص می گردد. در هنگام تشخیص باید سایر گزینه های مرتبط را رد کنیم. علائم اغلب همزمان با هم رخ نمی دهند اما بروز آنها در هر زمانی ممکن است.
چون علائم بهجت می تواند شبیه خیلی از بیماریها باشد، ممکن است در مراحل اولیه شناخته نشود. به همین دلیل، برای این که معیار درستی برای شناسایی وجود داشته باشد پزشکان چنین گفته اند: اگر در سال بیش از 3 بار به آفت ساده دهانی مبتلا شدید و کنار آن 2 علامت از علایم ذکر شده ذیل را هم داشتید حتما به ابتلای بیماری بهجت شک کنید.
معیارهای تشخیصی سندرم بهجت شامل
1- زخم های عود کننده تناسـ لی
2- ضایعات چشمی
3- ضایعات پوستی
4- ایجاد خراش های سطحی پوستی با کوچکترین تحریک وارده یا تست پاترژی

درمان
شدت علائم این سندرم معمولا با گذشت زمان کاهش می یابد و صرف نظر از بیماران مبتلا به عوارض عصبی دیگران می توانند به ادامه زندگی امیدوار باشند؛ اما پیشرفت زیاد بهجت می تواند منتهی به کوری برگشت ناپذیر شود. برای درمان ضایعات پوستی و مخاطی می توان از گلوکوکورتیکوئیدهای موضعی به صورت دهان شویه یا پماد استفاده کرد.
آسپرین و اینترفرون و کلشی سین نیز از داروهای دیگری هستند که برای درمان بهجت مورد استفاده قرار می گیرند. در صورتی که علائم بیماری با داروهای فوق کاسته نشد اقدام به تعویض پلاسمای فرد می کنند تا شدت علائم تا حدی کنترل شود. یافته ها :زخم های دهانی اغلب با به کار بردن کورتون های موضعی درمان می شوند .
داروهایی که با قدرت بیشتر از قبیل آزا یتو پرین ،سیکلوسپرین ، اینترفرون واینفلکسیمیب در متوقف کردن تظاهرات شدید سیستمیک از قبیل تظاهرات پوستی _ مخاطی مؤثرند .
نتیجه : درمان ارجح استفاده از ترکیب داروهای مختلف مي باشد که به صورت درمان های موضعی همراه با کورتون ها ، NSAIDS، کلشی سین ،داپسون وایمنوساپرسیوها وعوامل سایتو توکسیک است .
پیش آگهی
پیش آگهی این سندرم بستگی به تظاهرات بالینی آن دارد. بدترین پیش اگهی متعلق به افرادی است که دچار واسکولیت رتین (شبکیه) شده اند زیرا بروز این حالت منجر به از دست رفتن بینایی فرد می گردد. تشکیل آنوریسم های عروقی و احتمال گسیختگی آن و درگیری های عصبی، منجر به بروز فراموشی علی رغم انجام تمام مداخلات تهاجمی مناسب می گردد.
درمان سندرم بهجت علامتی و تجربی است . درگیری غشاء مخاطی ممکن است به گلو کو کورتیکوئید موضعی کورتون موضعی پاسخ دهد . مشکلات عروقی یعنی تشکیل لخته در عروق و خون مردگی و التهاب عروقی با آسپرین و دی پیریدامول درمان می شود . کلشی سین و انترفرون آلفا در درمان التهاب مفاصل این بیماران سودمند می باشند . درگیری چشمی و سیستم اعصاب مرکزی نیازمند درمان با کورتن یا سیکوسپورین می باشد . شدت بیماری معمولاً به مرور زمان فروکش می کند ، بجز مواردی که با عوارض عصبی باشد امید به زندگی مثل افراد عادی و نرمال است و تنها عارضه جدی در موارد شدید کوری است .
بیماری بهجت جزو بیماریهای اتوایمیون است که مکانیسم دقیق آن مشخص نمیباشد، این بیماری بیشتر در حوزه مدیترانه و کشورهای ژاپن و ترکیه شایع است هر چند که در مسیرش از ایران نیز گذر می کند.

سندرم بهجت(bs) يا بيماري بهجت يك واسكوليت (التهابعروق خوني) سيستميك با علت ناشناخته است كه با زخمهاي عودكننده دهان و ناحيهتناسلي و درگيري چشم، مفاصل، پوست، عروق و سيستم ايمني همراه است.سندرم بهجتبه افتخار يكپزشك ترك به نام پروفسور دكتر هولوسي بهجت كه اين بيماري را در سال 1937 شرح دادهاست، به نام او ناميده شده است.
موضوعات مرتبط: ايمونولوژي
اساس تست RPR:
آنتی ژن RPR یک سوسپانسیون کاردیولیپین حاوی ذرات بسیار ریز شارکول است. این آنتی ژن یک آنتی بادی ضد چربی را شناسایی می کند که به آن رآژین می گویند. رآژین در بیماران سیفلیسی و نیز گاهی در سرم بیماران مبتلا به دیگر بیماریهای حاد یا مزمن یافت می شود. هر گاه نمونه ای حاوی رآژِین ها باشد، یک فلوکولاسیون آنتی ژن بوجود می آید که ذرات شارکول را کواگول کرده و کلامپهای سیاه به اندازه های مختلف بر حسب تیتر آنتی ژن بوجود می آورد. با نمونه های فاقد رآژین هیچ واکنشی پدید نمی آید و یک سوسپانسیون یکنواخت خاکستری رنگ بر جا می ماند.
معرفها و اجزاء کیت: سوسپانسیون آنتی ژن RPR، ویال تقسیم کننده آنتی ژن، سر سوزن که هر قطره آن معادل 16/0 میلی لیتر است. پیپت برای انتقال و هم زدن سرم یا پلاسما، اسلاید
احتیاط: نمونه باید از بیمار در حالت ناشتا گرفته شود. سرمهای لیپیک ممکن است واکنش کاذب نشان دهند. با نمونه واضحاً همولیز شده آزمایش انجام نشود. نمونه های آلوده دور انداخته شوند. نیازی به غیر فعال کردن سرم نیست.

موضوعات مرتبط: ايمونولوژي
ادامه مطلب
تست HCG به روش آگلوتیناسیون:
این تست کیفی و نیمه کمی بر اساس واکنش ایمونولوژیک بین hCG متصل به ذرات لاتکس و آنتی بادی های مونوکلونال که بر علیه قسمت های خاصی از زنجیر B ساخته شده اند صورت می پذیرد. در این محصول از روش غیر مستقیم (indirect) جهت بالا بردن حساسیت استفاده شده است. بدین ترتیب اگر غلظت این هورمون حدوداً بیش از 5/0 واحد (IU) در میلی لیتر ادرار باشد، اتصال آنتی بادی به آنتی ژن متصل به ذرات لاتکس (که سبب آگلوتیناسیون می گردد) صورت نخواهد پذیرفت. عدم آگلوتیناسیون نشان دهنده حاملگی خواهد بود. بر اساس این روش در صورت حاملگی، تست در 8-6 روز پس از قطع پریود مثبت می شود.
معرفها: معرف شماره 1 = محلول آنتی بادی مونوکلونال، معرف شماره 2 = سوسپانسیون لاتکس، معرف شماره 3 = کنترل مثبت، معرف شماره 4 = کنترل منفی.
توجه: معرفها در یخچال (2 تا 8 درجه) تا تاریخ انقضاء کیت قابل استفاده خواهند بود.
- سوسپانسیون لاتکس را قبل از استفاده به آرامی تکان دهید و از انجماد آن جداً ودداری نمایید.
- معرفها حاوی Sodium azide می باشند. در مصرف آنها احتیاط کنید.
نمونه های آزمایش:
- جهت انجام آزمایش، اولین ادرار صبحگاهی که حاوی HCG بیشتری می باشد توصیه می شود.
- لازم است که نمونه های ادرار در ظروف خشک و تمیز بدون مواد شوینده جمع شوند.
- بسیار ضروری است که نمونه کاملاً شفاف باشد. مواد نا محلول در نمونه ممکن اسن باعث تداخل در واکنش و ایجاد نتایج کاذب شوند. قویاً توصیه می شود که در صورت نیاز جهت حصول به نمونه کاملاً شفاف ادرار صبحگاهی با دور بالا سانتریفوژ شود.
- توصیه می شود که نمونه های ادرار بلافاصله بعد از جمع آوری (تهیه) تست شوند یا اینکه در یخچال قرار داده شوند. در این صورت حداقل برای مدت 24 ساعت پایدار خواهند بود. برای مدتهای طولانی تر لازم است که نمونه ها Sodiumazide (1/0 درصد) اضافه شود. یا در فریزر (-20C) قرار داده شوند.
نمونه های فریز شده بایستی کاملاً شفاف باشند. در غیر اینصورت سانتریفوژ نمودن آنها ضروری است.
- وجود خون یا آلودگی های میکروبی می توانند باعث نتیجه غلط بشوند. در اثر مصرف بعضی از داروها امکان مشاهده نتایج کاذب وجود دارد.
روش آزمایش:
در انجام آزمایش تعیین حاملگی لازم است که اسلاید و نمونه ادرار به درجه حرارت اطاق رسیده باشند. رساندن سوسپانسیون لاتکس و محلول آنتی بادی به درجه حرارت اطاق ضروری نمی باشد. اسلاید را با آب ولرم بشویید و بلافاصله بخوبی خشک کنید. از نگهداری دراز مدت آن در آب خودداری فرمایید. مراحل زیر را به دقت انجام دهید.
الف- روش کیفی:
1- 50 میکرولیتر (یا یک قطره، با استفاده از قطره چکان همراه کیت) از نمونه های ادرار را در وسط دایره قرار دهید. سپس یک قطره از محلول آنتی بادی را در حالیکه ویال حاوی این معرف به حالت عمودی نگهداری شده است، در کنار آ«ها بچکانید.
2- با استفاده از همزن پلاستیکی، قطرات را طوری مخلوط نمایید تا کاملاً سطح داخلی دایره را پوشانده و حداقل برای مدت 30 ثانیه بصورت دورانی در دست یا با استفاده از روتاتور حرکت دهید.
3- سوسپانسیون لاتکس را به آرامی تکان دهید و یک قطره از آن را به هر یک از نمونه ها بچکانید.
4- با استفاده از همزن پلاستیکی، قطرات را مخلوط نموده و در سطح دایره ها پخش نمایید.
5- اسلاید را مجدداً بطور دورانی برای مدت 2 دقیقه حرکت دهید.
6- میزان آگلوتیناسیون را بصورت زیر گزارش کنید:
- بدون آگلوتیناسیون و کاملاً شیری منفی (حاملگی مثبت)
- آگلوتیناسیون مشخص مثبت (حاملگی منفی)
- آگلوتیناسیون ضعیف (مشکوک)
ب- روش نیمه کمی:
1- برای هر نمونه ادرار، 6 عدد لوله آزمایش را با شماره های 1 تا 6 علامت گذاری کنید.
2- 5/0 میلی لیتر PBS یا سرم فیزیولوژی را به لوله شماره 1 و 2/0 میلی لیتر از آن را به لوله های 2 تا 6 اضافه کنید.
3- به لوله شماره 1) 5/0 میلی لیتر از ادرار مورد آزمایش اضافه نمایید و تکان دهید تا مخلوط شود.
4- 2/0 میلی لیتر از محلول شماره 1 را به لوله شماره 2 اضافه کنید و بعد از مخلوط کردن این عمل را برای لوله های دیگر بطور سریال تکرار نمایید (2 به 3 ...)
5- هر کدام از نمونه های رقیق شده را بر اساس روش کیفی فوق بررسی کنید و از اطلاعات زیر جهت مشخص کردن مقدار نیمه کمی هورمون hCG استفاده نمایید (بعنوان مثال، اگر اگلوتیناسیون در نمونه اولیه که 32 برابر رقیق شده است دیده نشود، نمونه حدوداً حاوی 24 واحد از hCG در میلی لیتر خواهد بود).
رقت نمونه ادرار غلظت تقریبی hCG (Iu/ml)
1:2 5/1
1:4 3
1:8 6
1:16 12
1:32 24
1:64 48
موضوعات مرتبط: ايمونولوژي
CRP Quantitative و اهميت بالين آن:
CRP يک پرزوتئين فاز حاد التهابي است که در حالت نرمال به تعداد خيلي کم در سرم وجود دارد (کمتر از 5/0 mg/dl در پي هر گونه التهاب، آزردگي بافتي ممکن است اين پروتئين تا 100 برابر افزايش يابد. بنابراين اندازه گيري آن در بيماريهاي مختلف از جمله در عفونتها، التهابات، تروما و انفارکتوس ميوکارد ارزش ويژه اي داشته و در تشخيص افتراقي، پيگيري و تاييد درمان اين بيماريها کاربرد دارد.
امروزه ثابت شده است که در تعيين مقدار کمي (Quantitative CRP) يا (hs CRP) در مقايسه با ابررسي شاخص هاي ديگر التهاب مانند تب – درد- افزايش گلبولهاي سفيد خون (WBC) و سرعت رسوبي گلبولي (ESR) قابل اعتمادترين شاخص است و به دليل نيمه عمر کوتاه آن بعد از حذف عامل تحريک سريعاً کاهش مي يابد و بعنوان يک آزمون غربالگري سودمند براي تشخيص و تاييد و پيگيري درمان بيماريهاي عفوني التهابي (ميکروبي) ويرال و انواع بدخيمي ها و انفارکتوس ميوکارد بکار ميرود.
- ارزش CRP hs در تشخيص بيماريهاي التهابي و انفارکتوس ميوکارد:
1- در حال عادي کمتر از 0/5 mg/dl نرمال محسوب مي گردد.
2- در بيماران عفونت حاد باکتريايي ميزان آن به 350-150 mg/dl مي رسد.
3- در بيماران عفونت حاد ويروس حدود 40-20 mg/dl مي باشد.
4- در موارد انفارکتوس ميوکارد به ميزان 10-4 mg/dl افزاي مي يابد.
- امروزا از CRP کمي يا CRP hs در مايع نخاع (CSF) براي افتراق سريع مننژيت باکتريال از ويرال استفاده مي شود.
- با کنترل مدام ميزان hs CRP امکان تشخيص زود رس مشکلات احتمالي پس از سکته قلبي را ميسر مي سازد.
متد اندازه گيري hs CRP : ايمونو توربيومتري يا روش اليزا مي باشد.
روش انجام آزمايش CRP:
در گذشته از پلي ساکاريد C پنوموکوک براي تشخيص CRP استفاده مي شد ولي به علت مشکلاتي که در تهيه اين آنتي ژن وجود دارد، امروزه از کيتي که بدين منظور تهيه مي شود، براي تشخيص CRP در سرم استفاده مي شود. در اين کيت، از آنتي بادي ضد CRP (anti CRP) براي تشخيص CRP در سرم استفاده مي شود.
ازاي موجود در کيت CRP
1) قطه چکان حاوي سرم کنترل مثبت (Positive Control)
2) قطره چکان حاوي سرم کنترل منفي (Negative Control)
3) قطره چکان حاوي آنتي بادي ضد CRP از کلاس IgG، که بر سطح ذرات لاتکس متصل شده است.
4) اسلايدزمينه سياه
5) اپليکاتور
6) بافر براي رقيق کردن و تيراسيون سرم بيمار (در برخي از کيتها)
آزمايش CRP به دو روش کيفي و کمي انجام مي شود:
روش کيفي (اسلايدي):
روي اسلايد زمينه سياه يک قطره سرم بيمار، يک قطره سرم کنترل مثبت و يک قطره سرم کنترل منفي بريزيد.
شيشه محتوي ذرات لاتکس را به آرامي تکان داده، سپس به هر کدام از سه قطره سرم مرحله قبل، يک قطره از آن را اضافه نمايد.
با اپليکاتور هر کدام از سرم ها را با ذرات لاتکس، مخلوط نموده، به اندازه دايره اي به قطر دو سانتي متر پخش نمايد.
لام را به مدت 5 دقيقه به آرامي بر روي دست يا روتاتور حرکت دوراني داده و نتيجه آگلوتيناسيون را زير نور بررسي نموده به صورت زير گزارش نمايد.
آگلوتيناسيون درشت +++ (+3)
آگلوتيناسيون متوسط ++ (+2)
آگلوتيناسيون ريز + (+1)
آگلوتيناسيون مشاهده نمي شود (سوسپانسيون يکنواخت و شيري رنگ) – (منفي)
در صورت اثبات وجود CRP در سرم بيمار، به منظور اندازه گير ي مقدار و يا تيتر آن در سرم، روش کمي (لوله اي) را انجام دهيد.
نکته: گاهي اوقات مقدار CRP در سرم بيمار بسيار زياد است، در نتيجه به علت پديده منطقه اي (Zone Phenomenon) ممکن است يک سرم مثبت، اشتباهاً منفي گزارش شود. بنابراين بهتر است چنانچه آزمايش CRP سرمي منفي شد، قبل از اينکه آن را منفي گزارش نماييد با رقت 5/1 يا بيشتر آزمايش را تکرار نماييد.
روش نيمه کمي (لوله اي)
براي هر نمونه سرمي، شش عدد لوله آزمايش را با شماره هاي1 تا 6 علامت گذاري کنيد.
به همه لوله ها 50 لاندا (میکرولیتر) تامپون یا سرم فیزیولوژی اضافه نمایید.
به لوله شماره 1، 50 لاندا سرم بيمار را اضافه نموده با تکان دادن لوله محتويات داخل لوله را مخلوط نماييد. (غلظت 2/1)
سپس 50 لاندا از محلول لوله شماره 1 را به لوله شماره 2 اضافه کنيد و بعد از مخلوط کردن اين عمل را براي لوله های دیگر بطور سریال تکرار نمائید. (2 به 3 و ...).
در آخر 50 لاندا از محلول لوله شماره 6 را بیرون بریزید.
با این روش رقتهای مختلفی از سرم (2/1، 4/1، 8/1، 16/1و ...) تهیه می شود.
هر کدام از نمونه های رقیق شده را بر اساس روش کیفی بررسی کنید.
آخرین رقتی که واکنش آگلوتیناسیون در آن قابل مشاهده است به عنوان تیتر CRP گزارش نمایید.
موضوعات مرتبط: ايمونولوژي
پدیده منطقه ای یا پره زون:
در صورتی که غلظت آنتی بادی بیشتر از آنتی ژن باشد واکنش انجام نمی گیرد و احتمال جواب کاذب در لوله های اول وجود دارد که در تست رایت دیده می شود.
ب- روش اگلوتیناسیون سریع: Rapid Plate Agglutination Test
روی شیشه پاک و تمیزی بکمک خط کش و مداد شمعی حدود 64 مربع به ابعاد 5/1*5/1 سانتی متر می کشیم سپس با استفاده از پی پت 1/0 میلی لیتر و یا سمپلر (Sampler) مقادیر 08/0، 04/0، 02/0، 01/0، 005/0، 002/0 میلی لیتر از سرم خون بیمار را در شش خانه افقی ریخته و یک قطره از آنتی ژن مورد نظر را به آنها اضافه می نمائیم.
مخلوط آنتی ژن و سرم را توسط اپلیکا تور چوبی بخوبی بهم می زنیم. شاهد نیز یک قطره آنتی ژن در خانه هفتم است شیشه را چندین بار تکان داده و نتیجه آزمایش را بعد از یک دقیقه به شرح ذیل ثبت می نمائیم.
100% اگلوتیناسیون با علامت (++++)، 75% اگلوتیناسیون با علامت (+++)، 50% اگلوتیناسیون باعلامت (++)، 25% اگلوتیناسیون با علامت (+) و بالاخره اگلوتیناسیون منفی با علامت (-) مشخص می شود. (تابلوی شماره 2).
لازم به یادآوری است که در روش اگلوتیناسیون سریع چند نکته زیر را باید مد نظر داشت.
1- تیتراژ برابر است با عکس بالاترین رقتی که با مقایسه شاهد حداقل 50% (++) اگلوتیناسیون از خود نشان دهد.
2- بعد از اضافه نمودن آنتی ژن مقادیر 08/0 تا 02/0 میلی
لیتر از سرم خون به ترتیب معادل ![]() ،
،
![]() ،
،![]() ،
،![]() ،
،![]() ،
،![]() رقت خواهد شد.
رقت خواهد شد.
3- در این روش باید به محدودیت زمانی توجه خاصی نمودوضمن آزمایش نبایدشیشه الگوتیناسیون را نزدیک حرارت قرار دادکه هر دوصورت مقداری آب تبخیرگشته و نتیجه ای صحیح حاصل نمیگردد.
تابلو( 2)نمونه ثبت نتیجه در روش اگلوتیناسیون سریع
|
مقدارسرم (ml) |
رقت مشابه |
شدت اگلوتیناسیون نمونه اول |
نمونه دوم |
نمونه سوم |
|
8% |
1:20 |
*** |
*** |
**** |
|
4% |
1:40 |
** |
**** |
*** |
|
2% |
1:80 |
* |
*** |
** |
|
1% |
1:160 |
- |
** |
* |
|
005/0 |
1:320 |
- |
* |
- |
|
002/0 |
1:640 |
- |
- |
|
|
تیتر سوم |
|
40 |
160 |
80 |
|
مقدارسرم (ml) |
رقت مشابه |
شدت اگلوتیناسیون نمونه اول |
نمونه دوم |
نمونه سوم |
|
8% |
1:20 |
*** |
*** |
**** |
|
4% |
1:40 |
** |
**** |
*** |
|
2% |
1:80 |
* |
*** |
** |
|
1% |
1:160 |
- |
** |
* |
|
005/0 |
1:320 |
- |
* |
- |
|
002/0 |
1:640 |
- |
- |
|
|
تیتر سوم |
|
40 |
160 |
80 |
ج- روش اگلوتيناسيون لوله
اين روش که براي کليه نمونه سرمهاي مکشوک مورد استفاده قرار مي گيرد به مراتب حساس تر از روش اگلوتيناسيون سريع بوده و صرفا به وقت و لوازم آزمايشگاهي بيشتر نياز دارد.
روش آزمايش:
1- تهيه رقت آنتي ژن: در آزمايش ويدال ابتدا آنتي ژن سالمونلاي مورد نظري که براي آزمايش به روش آگلوتيناسيون سريع استاندارد گرديده را با محلول سرم فيزيولوژي فرمله (5/0% ) به نسبت⅛ رقيق مي نمائيم. در مورد آزمايش رايت ووايل فليکس بايد از آنتي ژني (بروسلا آبورتوس و پروتئوس ولگاريس) که براي آزمايش به روش لوله استاندارد گرديده استفاده نمود.
2- روش کار : تعداد ده لوله (10*100) را در جا لوله اي قرار داده و در لوله اول 9/0 و در کليه لوله هاي بعدي 5/0 ميلي ليتر سرم فيزيولوژي (9/0 در صد) مي ريزيم به لوله اول 1/0 ميلي ليتر سرم مورد آزمايش را اضافه نموده و بعد از مخلوط نمودن آنها بوسيله پي پت، 5/0 ميلي ليتر از آنرا به لوله دوم و 5/0 ميلي ليتر از لوله دوم را به سوم و به ترتيب تا لوله نهم انتقال مي دهيم ضمنا 5/0 ميلي ليتر مايع اضافي لوله نهم را دور مي ريزيم. به هر يک از لوله ها 5/0 ميلي ليتر از آنتي ژن رقيق شده و يا استاندارد شده براي روش لوله را اضافه نموده و بعد از بهم زدن به شرح زير در گرمخانه قرار مي دهيم.
آنتي ژنهاي فلاژلا سالمونلاها به مدت يک ساعت در 50 درجه و يا سه ساعت در 37 درجه سانتيگرد.
آنتي ژنهاي سماتيک سالمونلاها به مدت 16 ساعت در 50 درجه و يا 24 ساعت در 37 درجه سانتي گراد.
آنتي ژن بروسلا آبورتوس (لوله) به مدت 24 تا 48 ساعت در 37 درجه سانتي گراد.
آنتي ژنهاي پروتئوس ابتدا به مدت 2 ساعت در 37 درجه سپس 16-18 ساعت در 4 درجه سانتي گراد.
بعد از زمان اينکوباسيون، بوسيله نور فلورسنتي که در زمينه سياهي بتابد درجه آگلوتيناسيون را با مقايسه شاهد (لوله دهم که داراي 5/0 ميلي ليتر آنتي ژن است) طوري ثبت مي نمائيم که علامت (++++) مشخص کننده صد در صد اگلوتيناسيون آنتي ژن با آنتي کر باشد يا بعبارت ديگر هنگاميکه در ته لوله آگلوتيناسيون به خوبي مشاهده گرديده و مايع لولهمانند سرم فيزيولوژي کاملاً شفاف باشد.موضوعات مرتبط: ايمونولوژي
آزمایش 2ME-Wright Test:
این آزمایش پس از مثبت شدن آزمایش رایت انجام می شود تا کلاس آنتی بادی را تشخیص داد. با این آزمایش، مولکولهای IgM سرم از بین می روند ولی IgGو IgA نسبت به مواد احیا کننده در غلظتی که استفاده می شود، مقاوم است. مواد احیا کننده، پیوندهای دو سولفیدی (-S-S-) را بصورت SH، بین زنجیره های سنگین و سبک ایمونو گلبولین باز می کند. مهمترین کاربرد این آزمایش، تشخیص افتراقی بین بروسلوز فعال از غیر فعال در فردی که تظاهرات بالینی بیماری را ظاهراً دارد ولی کشت خون یا سایز نمونه ها، عاری از میکروب بروسلا و تیتر آزمایش رایت او نیز پائین است. بعلاوه با انجام این آزمایش می توان تأثیرر آنتی بیوتیک مناسب را در درمان بیماری تحت بررسی قرار داد.
محلولهای مورد لزوم:
1- تامپون یا بافر فسفات نمکی PBS=7.2 محتوی 1/0 مولار 2- مرکاپتواتانول ( محتوی 1/0 مولار 2- مرکاپتواتانول (2-ME)یا بافر فسفات نمکی محتوی 005/0 مولار 1 و 4- دی تیوترئیتول (DTT). از آنجایی که 2-ME بوی زننده ای دارد و باید در زیر هواکش یا هود (Hood) کار کرد، بنابراین اگر در آزمایشگاهی هود موجود نیست می توان از DTT استفاده کرد. بهتر است است تامپون 2- مرکاپتواتانل در روز آزمایش آماده شود و درب آن محکم بسته شده تا تبخیر و غیر فعال نگردد.
2- آنتی ژن بروسلا، سرم و سایر محلولهائی که برای این آزمایش بکار می روند باید فاقد فنل باشند، زیرا که فنل از کار مواد احیاء کننده (2-مرکاپتواتانل و دی تیوئیتول) جلوگیری می کند. در صورتی که آنتی ژن محتوی فنل باشد باید قبل از آزمایش چند بار آنرا با بافر فسفات نمکی شستشو داد.
روش کار:
1- تعداد 10 از لوله آزمایش سرولوژی را در جا لوله ای ممناسب قرار دهید. (جدول شماره 3-6).
2- مقدار 9/00 سانتی متر مکعب بافر فسفات نمکی محتوی ماده احیا کننده را در لوله آزمایش اول بریزید.
3- مقدار 1/0 سانتی متر مکعب سرم بیمار را به لوله اول آزمایش اضافه نموده و سر لوله را با کاغذ پارافیلم مسدود نمائید.
4- لوله اول را بمدت یکساعت در درجه حرارت اطاق یا 37 درجه سانتی گراد قرار داده و مواد احیا کننده اثر خود را نموده و باعث تجزیه و غیر فعال شدن IgM گردد.
موضوعات مرتبط: ايمونولوژي
روش انجام آزمایش کومبس – رایت
این آزمایش برای تشخیص آ«تی بادیهای ناقص (Incomplete) یا مسدود کننده (Blocking)، خصوصاً در موارد رجعت بروسلوز یا مرحله مزمن می باشد.
1- ابتدا آزمایش رایت معمولی در لوله را مطابق دستوری که گفته شده بطور کامل انجام داده و نتایج را یادداشت نمائید.
2- سپس لوله ها را به مدت 15 دقیقه در دور 2000 در دقیقه سانتریفیوژ و رسوب آنها را جدا و سه بار با سرم فیزیولوژی بشوئید.
3- پس از آخرین سانتریفیوژ، سرم فیزیولوژی بالای رسوب را دور ریخته و آخرین قطره آنرا روی دستمال کاغذی خارج نمایند. سپس به ته نشین هر لوله یک قطره سرم آنتی گلبولین انسانس Polyspecific (سرم کومبس) اضافه کرده و لوله ها را تکان دهید.
4- لوله ها را نیم تا یکساعت در بن ماری 37 درجه سانتیگراد قرار دهید.
5- لوله ها را بمدت 15 دقیقه در دور 2000 در دقیقه سانتریفیوژ نمائید.
6- نتیجه را با زدن ضربه آرامی به ته لوله ها بررسی و تیتر آخرین لوله ای که آگلوتیناسیون مشاهده گردید، گزارش نمائیدموضوعات مرتبط: ايمونولوژي
روش انجام آزمایش رزبنگال:
آزمایش رزبنگال در منابع مختلف به اسامی رزبنگال پلیت تست،
کاردتست ( Card test)، آزمون سریع یا
راپید ( test) و غیره نامیده می شود. آنتی ژن رزبنگال به رنگ قرمز متمایل به
صورتی و با PH
اسیدی برابر با 05/0 ![]() 6/3 و به جرم نهائی 8 درصد، از کلنی
های صاف (smooth) بروسلا آبورتوس سویه 99 یا 19 که فاکتورهای آنتی ژنی مشترکی با
دیگر سویه های بروسلا دارند، طبق روش استاندارد بین المللی در موسسه رازی. این
آنتی ژن جهت تشخیص اولیه در برنامه های کنترل و ریشه کنی بروسلوز بکار می رود.
آنتی ژن رزبنگال را باید دور از نور و در یخچال چهار درجه سانتی گراد نگهداری کرد
و تا زمانی که اتو آگلوتینه نشده، قابل مصرف است. قبل از انجام آزمایش باید ابتدا
آنتی ژن رزبنگال و سرم بیمار را از یخچال خارج کرده و در محیط آزمایشگاه به مدت 20
تا 30 دقیقه نگهداری نموده تا به دمای آزمایشگاه برسند. سپس روی یک صفحه شیشه ای
یا سفید یک قطره معادل 03/0 میلی لیتر سرم را مجاور یک قطره آنتی ژن قرار داده و
با یک میله نازک چوبی یا پلاستیکی، این دو قطره را با هم مخلوط و به اندازه دایره
ای به قطر حدود 5/2 سانتی متر پخش نمائید. سپس صفحه را در دست یا روی روتاتور بمدت
حداکثر چهار دقیقه حرکت داده و نتیجه آگلوتیناسیون را در زیر نور چراغ قرائت
نمائید. واکنش مثبت به حالتی گفته می شود که دانه های آگلوتینه بطور مشخص جدا از
هم دیده شوند و در موارد منفی، دو قطره مخلوط شده به حالت یکنواختی باقی خواهند
ماند. در آزمایش رزبنگال موارد مشکوک دیده نمی شود و نتیجه با قاطعیت مثبت یا منفی
می باشد.
6/3 و به جرم نهائی 8 درصد، از کلنی
های صاف (smooth) بروسلا آبورتوس سویه 99 یا 19 که فاکتورهای آنتی ژنی مشترکی با
دیگر سویه های بروسلا دارند، طبق روش استاندارد بین المللی در موسسه رازی. این
آنتی ژن جهت تشخیص اولیه در برنامه های کنترل و ریشه کنی بروسلوز بکار می رود.
آنتی ژن رزبنگال را باید دور از نور و در یخچال چهار درجه سانتی گراد نگهداری کرد
و تا زمانی که اتو آگلوتینه نشده، قابل مصرف است. قبل از انجام آزمایش باید ابتدا
آنتی ژن رزبنگال و سرم بیمار را از یخچال خارج کرده و در محیط آزمایشگاه به مدت 20
تا 30 دقیقه نگهداری نموده تا به دمای آزمایشگاه برسند. سپس روی یک صفحه شیشه ای
یا سفید یک قطره معادل 03/0 میلی لیتر سرم را مجاور یک قطره آنتی ژن قرار داده و
با یک میله نازک چوبی یا پلاستیکی، این دو قطره را با هم مخلوط و به اندازه دایره
ای به قطر حدود 5/2 سانتی متر پخش نمائید. سپس صفحه را در دست یا روی روتاتور بمدت
حداکثر چهار دقیقه حرکت داده و نتیجه آگلوتیناسیون را در زیر نور چراغ قرائت
نمائید. واکنش مثبت به حالتی گفته می شود که دانه های آگلوتینه بطور مشخص جدا از
هم دیده شوند و در موارد منفی، دو قطره مخلوط شده به حالت یکنواختی باقی خواهند
ماند. در آزمایش رزبنگال موارد مشکوک دیده نمی شود و نتیجه با قاطعیت مثبت یا منفی
می باشد.
تبصره 1: آ«تی ژن رزبنگال موسسه رازی را نباید رقیق کرد. در صورت رقیق کردن، خصوصیات آنتی ژن مانند تعداد ذرات میکروبی، PH و الکترولیتهای آن تغییر می کند و جوابهای مثبت یا منفی کاذب که با وضعیت بالینی هماهنگی ندارند، ایجاد می شود.
تبصره 2: آنتی ژن رزبنگال را نباید برای روش لوله ها استفاده کرد.
تبصره 3: آنتی ژن رزبنگال، نباید یخ بزند.
موضوعات مرتبط: ايمونولوژي
آزمایش رایت: Wright Test:
برای تشخیص بیماری بروسلوزیس که بنامهای دیگر نظیر تب مالت، تب مواج نیز مشهور است بکار می رود عامل بیماری شامل باکتری زیر می باشد:
1- بروسلا آبور توس B.abortus عامل بیماری در گاو
2- بروسلا ملی تنسیس B.Melitensis عامل بیماری در گوسفند و بز
3- بروسلا کانیس B. canis عامل بیماری در سگ
4- بروسلا سوئیس B. suis عامل بیماری در خوک
روشهای تشخیص سرولوژیکی بروسلوز:
1- تهیه سرم:
از بیمار خون گرفته و سرم آن را جدا نمایید. چنانچه در روز تهیه سرم، نمونه مورد آزمایش قرار نگیرد، لازم است که تا روز آزمایش سرمها را در حرارت 8-2 درجه سانتیگراد نگهداری نمود.
2- تست سریع یا آنگلوتیناسیون اسلایدی:
طبق جدول ذیل مقادیر مختلف سرم مورد آزمایش و آنتی ژن بروسلایی را در حفرات یا دوایر اسلاید شیشه ای مخصوص به وسیله پیپتهای سرولوژی اضافه نمائید. پس از اضافه کردن آنتی ژن، با آپلیکاتور از رقت پایین به رقت بالا محتوات آن را مخلوط می کنیم و بمدت 5 دقیقه در روی روتاتور حرکت دورانی می دهیم.
روش راپید:
|
شماره حفرات اسلاید 1 2 3 4 5 |
|
سرم بیمار به میلی لیتر 08/0 04/0 02/0 01/0 005/0 |
|
مقدار آنتی ژن بروسلایی یک قطره یک قطره یک قطره یک قطره یک قطره |
|
رقت سرم 20 40 80 160 320 |
|
حدود تیتر آنتی بادی 20/1 40/1 80/1 160/1 320/1 |
3- تست استاندارد لوله ای:
طبق جدول مقابل مقادیر مختلف سرم فیزیولوژی، سرم بیمار و
آنتی ژن را که همان آنتی ژن مورد مصرف در روش اسلایدی است با این اختلاف که قبلاً
با سرم فیزیولوژی 20 بار رقیق شده است را به ده لوله همولیز تمیز (میلیمتر 100*
![]() 13) به ترتیب زیر اضافه نمایید:
13) به ترتیب زیر اضافه نمایید:
سپس محتویات لوله ها را مخلوط نموده و با جا لوله ای به مدت 48 ساعت در حرارت 37 درجه سانتیگراد قرار دهید و سپس با ضربه مختصری به انتهای لوله آزمایش آگلوتیناسیون را در ته لوله ها مشاهده کنید. آخرین لوله ای که آگلوتیناسیون داده باشد تیتر آنتی بادی را مشخص می کند. مثلا اگر آخرین لوله که در آن آگلوتیناسیون مشاهده شده است لوله شماره 6 باشد، تیتر آنتی بادی در سرم مورد آزمایش برابر 640/1 خواهد بود. یکی از طریق مطالعه آگلوتیناسیون برای صرفه جوئی در وقت، سانتریفوژ سریع لوله ها در 3000rpm به مدت یک دقیقه و مطالعه آگلوتیناسیون می باشد.
جدول رایت لوله ای:
|
شماره لوله 1 2 3 4 5 6 7 8 9 10 |
|
سرم فیزیولوژی به ml 9/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 |
|
سرم بیمار ml 1/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 |
|
ابتدا به لوله شماره یک 0/1ml سرم بيمار را افزوده و محتویات را مخلوط نموده و 0/5ml برداشته و به لوله دوم منتقل کنید و این عمل را تا لوله شماره 9 ادامه دهید. سپس از لوله شماره 9، 0/5ml برداشته و دور بریزید و لوله دهم لوله کنترل آنتی ژن است. |
|
آنتی ژن رقیق ml 5/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 5/0 محتویات کل لوله ها برابر 1ml است |
|
رقت نهایی سرم 20 40 80 160 320 640 1280 2560 5120 |
|
تیتر سرم 20/1 40/1 80/1 160/1 320/1 640/1 1280/1 2560/1 5120/1 |
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
آزمایش کومبس مستقیم:
هدف:
تعیین D-Anti هایی است که توسط مادر تولید شده و روی RBC جنین اتصال یافته اند. بنابراین نمونه لازم همان خون بند ناف (یا گلبولهای قرمز نوزاد) خواهد بود و این آزمایش هنگام تولد از نوزاد انجام می گیرد تا به موقع تعویض خون انجام شود.
آزمایش کومبس غیر مستقیم:
هدف:
تعیین آنتی کرهای D از سرم مادر است این آزمایش از سرم مادر در زمان قبل از حاملگی یا مراحل اول حاملگی انجام می گیرد تا مشخص شود آیا مادر در زایمان اول حساس شده یا نه.
آزمایش کومبس غیر مستقیم:
a- مرحله حساس
کردن گلبول قرمز: ابتدا از گلبولهای قرمز گروه خونی O و Rh+
![]() سوسپانسیون 5% تهیه می
کنیم.
سوسپانسیون 5% تهیه می
کنیم.
1- در یک لوله آزمایش 12×
![]() 100 مقدار 100 میکرولیتر سوسپانسیون فوق را میریزیم.
100 مقدار 100 میکرولیتر سوسپانسیون فوق را میریزیم.
2- مقدار 100 میکرولیتر سرم بیمار (مادر حامله) را اضافه می کنیم.
3- بمدت 30 دقیقه در بن ماری 37 درجه سانتیگراد انکوبه میکنیم.
b- مرحله شستشو و کومبس:
4- گلبولهای قرمز حساس شده فوق را 3 بار با سرم فیزیولوژی می شوییم.
5- پس از آخرین سانتریفوژ، لوله آزمایش را برگردانده و تمام سرم فیزیولوژی را خارج کرده و آخرین قطره را با دستمال کاغذی پاک می کنیم.
6- دو قطره معرف کومبس (آنتی هیومن- گلوبولین) را به لوله فوق اضافه می کنیم.
7- 3 دقیقه در حرارت 37 درجه سانتیگراد قرار می دهیم.
8- یک دقیقه در دور 1000 سانتریفوژ می کنیم.
تفسیر: نتیجه ازمایش را با ضربه ملایم به ته لوله بررسی می کنیم. آگلوتیناسیون مثبت دلالت بر حساس بودن سیستم ایمنی بدن بیمار بر علیه آنتی ژن مذکور می باشد.
در آزمایش کومبس مستقیم از خون بند ناف یا خون نوزاد بعد از تولد استفاده کرده و از مرحله 4 به بعد را انجام می دهیم.
کاربرد آزمایش کومبس غیر مستقیم:
1- مادران Rh منفی که احتمالاً بر علیه ژنD حساس شده اند.
2- آزمایش کراس مچ
3- تشخیص آنتی ژن RhDu
![]() (تست
تکمیلی Rh
و کومبس)
(تست
تکمیلی Rh
و کومبس)
4- تشخیص گروههای خونی kellو Duffy و kidd
5- تشخیص آنتی بادیهای ناقص یا مسدود کننده.موضوعات مرتبط: ايمونولوژي
ادامه مطلب
هماگلوتيناسيون:
اگر آنتي ژن ذره اي خود گلبول قرمز (Heme) باشد. آگلوتيناسيون حاصله را هماگلوتيناسيون مي گويند. مثل تعيين گروههاي خوني، مثل تست هماگلوتيناسيون براي منونوکلئوز عفوني _ تست هماگلوتيناسيون براي کيست هيداتيک
طرز تهیه سوسپانسیون 5-3% گلبول قرمز
برای اینکار ابتدا چند سی سی خون کامل (مثلاً 2-1 سی سی ) را در داخل یک لوله آزمایش ریخته و لوله را پر از سرم فیزیولوژی می کنیم و آنرا به آرامی مخلوط می کنیم.
مرحله شستشو:
1- لوله را در داخل سانتریفوژ با دور 3000 بمدت 5-3 دقیقه سانترفیوژ می کنیم
2- لوله را از سانترفیوژ برداشته با سر و ته کردن آرام لوله مایع سفید رویی را دور می ریزیم.
3- کمی سرم فیزیولوژی به لوله اضافه کرده، آنرا آرام مخلوط کرده و سپس لوله را با سرم فیزیولوژی پر می کنیم.
4- مجدداً سانتریفوژ می کنیم و از مرحله دوم به بعد را 4-3 بار تکرار می کنیم.
5- در مرحله آخر مایع رویی را دور ریخته و گلبولهای قرمز رسوب شده را به آرامی به هم می زنیم.
مرحله تهیه سوسپانسیون 5%: 5/0 سی سی از RBC شسته شده را برداشته و در داخل یک لوله بزرگ ی بشر کوچک می ریزیم و سپس روی آن 5/9 سی سی سرم فیزیولوژی اضافه می کنیم. (5/0 = 5%)
اگر خون شسته شده زیاد باشد می توان حجم بیشتر از سوسپانسیون را تهیه کرده مثل 95cc- RBC5cc سرم فیزیولوژی.موضوعات مرتبط: ايمونولوژي
مقدمه اي بر سرولوژي:
سرولوژي علم مطالعه سرم ها است، از ديد اختصاصي تر، سرولوژي شامل مطالعه واکنش هاي آنتي ژن_ و آنتي بادي در خارج از بدن است (Invitro)
مصونيت روشهايي است که توسط آنها ارگانيسم زنده از خود در مقابل عفونت دفاع مي کند. ايمونولوژي علم مطالعه توليد آنتي بادي بر عليه آنتي ژنهاي بيگانه در بدن است (In vivo).
لغت مصونيت يا Immunity به معني مقاومت نسبت به عوامل مولد عفونت، ذرات بيگانه، توکسين ها سلولهاي زنده و سرطان مي باشد.
1- اساس و پايه آزمايشات سرولوژي:
آزمايشات سرولوژي باليني يکي از روشهاي سريع و اسان در تشخيص بيماريها مي باشد اين آزمايشات بر اساس اتصال آنتي باديهاي اختصاصي (Specific antibody) به آنتي ژن مربوطه صورت مي گيرد. آنتي ژن مورد نظر مي تواند باکتري، ويروس، گلبول قرمز، پروتئين، هورمون يا چيزي يا چيزي ديگر باشد.
اتصال آنتي ژن به آنتي بادي يک واکنش اختصاصي، دو طرفه و برگشت پذير مي باشد و از قوانين تئوري عکس العمل بين اسيدهاي ضعيف و بازهاي پيروي مي کند.
· آنچه که بايد در رابطه با آزمايشات سرولوژيک بدانيم:
1-1- عواملي که بر واکنشهاي آنتي ژن و آنتي بادي دخالت مي کنند.
1-2- انواع واکنشهاي سرولوژيک
1-1- عواملي که بر واکنشهاي آنتي ژن و آنتي بادي دخالت مي کنند:
a- affinity يا قدرت اتصال آنتي بادي به آنتي ژن:
a2- Avidity: قدرت اتصال آنتي بادي به آنتيژنهاي پلي والان را آويديتي مي گويند
b- PH محيط:
c- قدرت يوني محيط (ionic strength):
d_ زمان:
E_ درجه حرارت:
F_ تأثير حرکت دادن:
H_ نسبت غلظت آنتي ژن و آنتي بادي:
G_ تأثير مواد احياء کننده:
2-1- انواع واکنشهاي سرولوژيک:
طبقه بندي واکنشهاي سرولوژيک بر اساس شکل مولکولي آنتي ژن يا کار آنتي بادي و آنتي ژن انجام مي گيرد.
انواع واکنشهاي سرولوژيک بر اساس شکل مولکول آنتي ژن:
a_ واکنشهاي متراکم يا آگلوتيناسيون (Agglutination):
b- واکنشهاي رسوبي يا پرسيپيتاسيون (Precipitation):
c- واکنشهاي فلوکولاسيون (Fluccolation):
4-2-1: انواع واکنشهاي سرولوژيک بر اساس کار آنتي بادي و آنتي ژن:
1: واکنشهاي آگلوتيناسيون
2: واکنشهاي پرسيپيتاسيون
3: واکنشهاي نوتراليزاسيون
4: واکنشهاي فيکساسيون کمپلمان يا ثبوت مکمل
5: واکنشهاي ايمونوالکتروفورز
6: واکنشهاي نشاندار با مواد فلوئورسان: (IF)
7: واکنشهاي نشاندار با آنزيم (Enzyme Immuno assay) (EIA)
8: واکنشهاي نشاندار با مواد راديو اکتيو (RIA)
9: واکنشهاي کمي لومينسانس
موضوعات مرتبط: ايمونولوژي
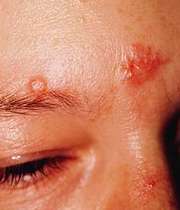
در بیماری سارکوئیدوز (Sarcoidosis)، التهاب در گره های لنفاوی، ریه ها، کبد، چشم ها، پوست و دیگر بافت ها رخ می دهد.
علل
علت این بیماری هنوز مشخص نشده است.
در این بیماری، توده کوچکی از بافت غیرطبیعی (گرانولوما) در اندام های خاص بدن شکل می گیرد.
گرانولوماها، خوشه هایی از سلول های ایمنی هستند.
در برخی مبتلایان، این گرانولوماها از بین نمی روند و در نتیجه موجب التهاب بافت و زخم شدن آن می شوند.
این بیماری، تقریبا تمام اندام های بدن را مورد حمله قرار می دهد، اما اغلب بر ریه ها اثر دارد.
علل احتمالی سارکوئیدوز عبارتند از:
- واکنش شدید سیستم ایمنی به عفونت
- حساسیت زیاد به عوامل زیست محیطی
- عوامل ژنتیکی
زنان بیشتر به این بیماری دچار می شوند.
این بیماری در سن 20 تا 40 سالگی شایع است.
سارکوئیدوز در کودکان بسیار نادر است.
هنگامی که علائم رخ می دهد، این علائم تقریبا تمام بدن و اندام ها را درگیر می کند.
بیشتر مبتلایان دارای علائم ریوی می باشند.
- درد سینه
- سرفه های خشک
- تنگی نفس
- خستگی
- تب
- احساس ناراحتی
- کاهش وزن
- ریزش مو
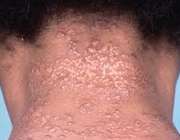
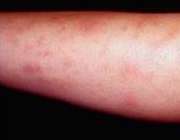
- برآمدگی های قرمز در صورت و بازوها
- زخم های برجسته، قرمز رنگ و سفت (اریتم ندوزوم) در جلوی ساق پا
- خارش پوست و ظهور جوش
- زخم هایی که بزرگ و ملتهب می شوند.
- سردرد
- تشنج
- تعریق شبانه
- ضعف در یک قسمت صورت
- تاری دید
- ترشح اشک از چشم
- خارش چشمان
- از دست دادن بینایی
- دهان خشک
- خون دماغ
- غش کردن
- ورم قسمت بالایی شکم
راه های تشخیص
- صدای تنفس
- بزرگ شدن کبد
- بزرگ شدن غدد لنفاوی
- بزرگ شدن طحال
- بزرگ شدن غدد بزاقی
- وجود کیست در بافت استخوانی
- تحریک پوست و خارش
- عکسبرداری از قفسه سینه
- CT اسکن قفسه سینه
- اسکن ریه
- نمونه براداری از ریه و دیگر بافت های بدن
- شمارش کل گلبولهای قرمز خون
- آزمایش های عملکرد کبد
درمان
علائم سارکوئیدوز، بدون درمان، به خودی خود بهتر خواهند شد.
بیمارانی که چشم، قلب، سیستم اعصاب و یا ریه هایشان درگیر شده است، ممکن است نیاز به کورتیکواستروئید داشته باشند.
درمان ممکن است 1 تا 2 سال ادامه داشته باشد. برخی از بیماران نیز ممکن است به درمان مادام العمر نیاز داشته باشند.
داروهای سرکوب گر سیستم ایمنی ممکن است نیاز باشد. به ندرت، برخی از بیماران نیاز به پیوند قلب و یا ریه پیدا می کنند.
- عفونت قارچی ریه
- آب سیاه و کوری چشم (به ندرت)
- سنگ کلیه به علت افزایش کلسیم خون و یا ادرار
- پوکی استخوان و دیگر عوارض ناشی از مصرف کورتیکواستروئیدها برای مدت زمان طولانی
- پرفشاری خون ریوی
- ناباروری در مردان
مرگ در اثر این بیماری کمتر از 5 درصد می باشد و به دلایل زیر رخ می دهد:
- خونریزی بافت ریه
- تخریب و نابسامانی قلب و تپش نامنظم قلب
- زخم در ریه
درمان های خانگی
- سیگار نکشید.
- در معرض گرد و غبار و مواد شیمیایی که ممکن است به ریه ها آسیب برسانند، قرار نگیرید.
- رژیم متعادل داشته باشید. به مقدار زیاد میوه جات و سبزیجات و غلات را مصرف کنید.
- روزانه 8 تا 10 لیوان آب مصرف کنید.
- 6 تا 8 ساعت در شب بخوابید.
- مرتب ورزش کنید.
- وزن خود را متعادل کنید.
- مصرف زنجبیل و روزماری مفید است.
- برای کاهش استرس می توانید از ویتامین های گروه B استفاده کنید.
- ماساژ گرمایی نیز برای این بیماران خوب است.
- ماساژ با روغن های تسکین دهنده مثل روغن روزماری، کاج و یا اکالیپتوس.
بارداری و سارکوئیدوز
بسیاری از زنان جوان مبتلا به سارکوئیدوز، در حالی که درمان می شوند می توانند نوزادان سالم به دنیا بیاورند. اما بهتر است با پزشک خود در تماس باشند.
معاینات پزشکی در طول بارداری و بلافاصله بعد از آن، برای بیمار مبتلا به سارکوئیدوز مهم است.
موضوعات مرتبط: ايمونولوژي
آنتی ژنهای بروسلا: آنتی ژنهای AوM به لیپو پلی ساكارید دیواره سلول باكتری مربوط میباشد ضمنا" بروسلا آنتی ژن مشترك با ویبره كلره داشته و واكسیناسیون بر علیه وبا تیتر آنتی بادی بروسلا را بصورت كاذب با بعضی از آنتی ژنهای ساخته شده بالا می برد. آنتی بادی: در پاسخ ایمنی هومورال بروسلوز ) IgG,IgM 1IgGوIgG2 IgA,( مقدار جزئی IgE تولید گردیده كه بویژهIgG , IgM در آزمایشگاههای سرولوژی دخالت دارند ودر عفونت بروسلوز, IgM از روز پنجم تا هفتم ظاهر شده و در طی 13 تا 21 روز پس از ورود باكتری در بدن به میزان نهایی خواهد رسید. IgA نیز به مقدار كم در فاصله بین ظهور دو ایمونوگلوبولین فوق الذكر بوجود می آید. در حالت بیماری تیتر IgG به مقدار بالا تر رسیده و دوام بیشتری دارد و در بررسی سرولوژی بروسلوز هنگامی كه سرم مورد آزمایش قرار می گیرد از ارزش زیادی برخوردار است . بدون تردید چنانچه سرم هفته اول آلودگی مورد بررسی باشد هیچگونه ایمونو گلوبولینی موجود نبوده و در نتیجه آزمایش منفی خواهد بود. در هفته دوم نقش برتر را IgM خواهد داشت. بین هفته دوم وسوم تشكیل IgG شروع شده و سه هفته پس از آن به اوج خواهد رسید و در حالت عفونت كماكان نقش غالب را خواهد داشت .برای تشخیص سرولوژی بروسلوز انسان ازمایشهای رزبنگال , سرو آگلوتیناسیون رایت , 2- مر كاپتواتانول , ثبوت عناصر مكمل وآنتی گلوبولین كومبس به روش استاندارد ویا استفاده از روشهای استاندارد شده توسط تولید كننده های داخلی انجام می پذیرد. اكثر بیماران مبتلا به بروسلوز حاد در تمامی آزمایشها واكنش مثبت نشان میدهد معمولا" آزمایشهای رزبنگال و رایت به جهت آنكه هر دو ایمونوگلوبین GوM در آنها دخالت دارند زودتر از دیگر آزمایشها واكنش دارد. در آزمایشهای 2- مركاپتواتانول وثبوت عناصر مكمل, IgG مداخله نموده كه از نقطه نظر تفكیك وضعیت ایمنی یا عفونت مفید می باشد. در مواردی كه آنتی بادی هایی وجود داشته باشند و آگلوتیناسیون واضح ایجاد نمی نماید آزمایش كومبس ازارزش خاصی برخوردار است. در بررسی سرولوژی بیماری تعیین تفاوت تیتر دو نمونه سرم در حداقل به فاصله دو هفته با ارزش می باشد ضمنا" در افرادی كه تماس مكرر با آنتی ژن بروسلا دارند آزمایشهای سرمی مثبت بدون علائم بالینی مشاهده می شود از اینرو نتایج آزمایشهای سرمی در بروسلوز شغلی از اهمیت محدودی برخوردار است. گاهی اوقات نیز نتایج مثبت کاذب ناشی از واکنش متقاطع سایر آنتی بادیهای باکتریها با آنتی ژن بروسلا مشاهده می گردد. بنا براین به منظور تشخیص بروسلوز بکارگیری روشهای استاندارد آزمایشگاهی توام با اطلاعات کسب شده اپید میولوژی - کلینیکی- آزمایشگاهی مورد نظر میباشد. روشهای سرولوژی استاندارد: 1-روش آگلوتیناسیون سریع با آنتی ژن ویژه این روش (لوازم مورد لزوم): 1-پلیت شیشه ای مخصوص آزمایش سرولوژی 2-آنتی ژن قابل مصرف و فاقد اتو آگلوتیناسیون 3-كنترل مثبت و كنترل منفی 4-روتاتور واپلیكاتور جهت مخلوط نمودن سرم و آنتی ژن آنتی ژن رزبنگال به رنگ قرمز و باPH اسیدی برابر 65/3 و به میزان 8% جرم میكربی بروسلا آبورتوس در دسترس می باشد و بیشتر این روش جهت تشخیص اولیه در برنامه های كنترل و ریشه كنی بروسلوز به عنوان تست غربالی بكار برده می شود و توصیه می شود بعلت احتمال بروز پدیده پروزون و مشاهده پاسخ منفی كاذب ، آزمایش تمامی نمونه های سرم با روش لوله ای انجام شود . در صورت انجام ازمایش به روش سریع و بر روی پلیت ، از یك قطره سرم ( حدود 25-30 میكرو لیتر )و یك قطره آنتی ژن (حدود25-30میكرولیتر) استفاده می شود و موارد مثبت به روش لوله تعیین مقدار شود و از تیتراسیون تست با پلیت خودداری گردد و سعی شود كه در این آزمایش از كنترل مثبت و منفی استفاده شود و آگلوتیناسیون با نمونه كنترلی منفی و مثبت مقایسه گردد. 2-آزمون آگلوتیناسیون رایت در لوله: (لوازم و مواد مورد نیاز): 1-لوله همولیز 2-آنتی ژن مخصوص لوله ای ساخت داخل كه فاقد اتو آگلوتیناسیون باشد و قابل مصرف طبق تاریخ ساخت می بایستی تا هنگام مصرف دور از نور و در یخچال 4 درجه سانتی گراد نگهداری شود. 3- نمك طعام و فنل 4-پارافیل جهت بستن درب لوله ها 5-سرم كنترل مثبت و منفی جهت تهیه شاهد طرز تهیه سرم فیز یولوژی فنیكه : 5/8 گرم كلرور سدیم و 5 گرم فنل را در 1000 میلی لیتر آب مقطر حل نمایید. توصیه می شود برای از بین بردن پدیده پروزن بجای 5/8 گرم 50 گرم نمك طعام و5 گرم فنل را در یك لیتر آب حل نمایید. روش آزمایش : در یك ردیف لوله همولیز از سرم مورد آزمایش رقت های 1:5 , لغایت 1:1280 به ترتیب ذیل تهیه نمایید : A: در لوله اول8/ . میلی لیتر و در لوله های بعدی 5/ . میلی لیتر سرم فیزیولوژی فنیكه بریزید . B: 2/ . میلی لیتر از سرم مورد آزمایش به لوله اول اضافه كرده (رقت 1:5 ) از لوله اول نیم میلی لیتر به لوله دوم اضافه كنید (رقت 1:10 ) مخلوط نموده به همین ترتیب تا لوله آخر ادامه داده و از لوله آخر 5/ . میلی لیتر اضافه را بعد از مخلوط كردن دور بریزید . C: آنتی ژن را به مقدار مورد نیاز تهیه (در صورت نیاز به رقیق شدن بر حسب دستور العمل رقیق گردد) و به هر لوله 5/ . میلی لیتر اضافه نمایید در نتیجه رقت های نهایی با احتساب حجم آنتی ژن 1:10 , 1:20 , 1:80 و ... الی آخر بدست آید . D: تهیه شاهد منفی و مثبت: (1) برای تهیه شاهد منفی 5/ . میلی لیتر آنتی ژن رقیق شده یا آماده مصرف را در یك لوله همولیز ریخته و نیم میلی لیتر محلول سرم فیزیولوژی فنیكه به آن می افزاییم . (2) برای تهیه شاهد مثبت یك نمونه سرم مثبت قوی را به صورت 1:5 رقیق نمایید . (100 میكرولیتر سرم + 400 میكرولیتر سرم فیزیولوژی فنیكه) سپس 5/ . میلی لیتر از آن را با 5/ . میلی لیتر آنتی ژن آماده مصرف در یك لوله ریخته و مخلوط نمایید . E: محتوی لوله ها را كاملا" مخلوط و درب لوله ها را با پارافیلم بسته و به مدت 20 تا 24 ساعت در گرمخانه 37 درجه سانتی گراد قرار داده و به ترتیب نتیجه را قرائت می كنیم . قرائت نتایج : بر مبنای میزان شفافیت مایع فوقانی (با مقایسه لوله شاهد ) و آگلوتیناسیون ایجاد شده نتایج بر حسب تیتر لوله ها (رقت لوله ها ) گزارش می گردد و با بیشترین رقت لوله ای كه نسبت به لوله شاهد منفی ، 50 درصد شفافیت یا آگلو تیناسیون را نشان می دهد تیتر نهایی آزمایش بدست می دهد . ضمنا" در مورد تفسیر آزمایش رایت وتعیین تیتر آلودگی هنوز اتفاق نظر وجود ندارد . در كتب و مقالات پزشكی غربی به علت اینكه بیماری شیوع چندانی ندارد و تعداد مبتلایان اندك می باشد و فقط بیماری یك بیماری شغلی محسوب شده و به وسیله بروسلا آبورتوس و سوئیس با تماس مكرر بوجود می آید و آلودگی با بروسلا ملی تنسیس رواج ندارد، تیتر قابل ارزش برای درمان 1:160 میباشد، ولی در ایران بیشتر آلودگی با بروسلا ملیتنسیس گزارش شده و شیوع بیشتری دارد و تیتر 1:80 به بالا برای درمان ارزش بیشتری دارد لیكن تیتر های پایین تر و بویژه در ارتباط با بیماریهای غیر شغلی نبایستی كم اهمیت در نظر گرفته شود، مگر در صورتیكه از نظر كلینیكی تظاهرات وجود نداشته ، تیتر آزمایش دو هفته بعد رو به افزایش نبوده ، كشت خون منفی بوده ، یا در آزمایش IgG , 2ME فعال وجود نداشته باشد . آزمایش 2- مركاپتواتانول: 2-Mercaptoethanol(2ME)Brucella Agglutination Test تستهای معمول آگلوتیناسیون برای تشخیص بروسلوز تنها وجودیا عدم آگلوتینین های ضد آنتی ژن بروسلا را در سرم بیمار مشخص می نماید. بدون آن كه قادر به افتراق نوع آگلو تینین های موجود یعنیIgM از IgG باشند . آزمایش 2ME برای تعیین ماهیت ایمونوگلوبولین موجود در سرمی كه سبب اگلوتیناسیون می شود انجام میگیرد . 2- مركاپتواتانول ماده احیاء كننده ایست كه درغلظت معین باندهای دی سولفید (disulphide bond ) IgM را شكسته وباعث از بین رفتن خاصیت آگلو تیناسیون IgM می شود . اگر سرم بیمار قدرت آگلوتیناسیون خود را پس از مجاورت با 2ME از دست بدهد نشاندهنده اینست كه آگلوتینین موجود IgM بوده است ولی اگر قدرت آگلوتیناسیون سرم پس از تاثیر 2ME باقی بماند دلیل بر وجود آگلوتینین IgG و تیتر بدست آمده همان تیتر IgG میباشد . آزمایش 2ME به همان روش آگلوتیناسیون لوله ای رایت (Wright) انجام می گیرد با این تفاوت كه رقتهای سرم ، در سرم فیزیولوژی حاوی 2ME تهیه می گردد. می توان بجای 2ME از ماده دیگری بنام Dithiothrietol( محلولی با غلظت 005/0 مولكول گرم ) استفاده كرد . ضمنا به سبب قابلیت اكسید شدن بیش از حد 2MEدر رقتهای بالا اعتقاد بر این است كه باید از بافر تازه تهیه شده 2MEبرای تعیین طبیعت آنتی بادی موجود در سرم بیمار استفاده گرددو پیشنهاد می نماید كه برای این هدف بهتر است ماده احیاء كننده را تازه و روزانه و با سرم مورد آزمایش مخلوط نموده و سپس آزمون آگلوتیناسیون را ا نجام داد . روش انجام آزمایش : مواد مورد لزوم : 1- محلول غلیظ2- مركاپتو اتانول 2- لوله همولیز 3- آنتی ژن لوله ای انستیتو پاستوریا انستیتو رازی كه اتو آگلو تیناسیون نداشته و یكنواخت و هموژن باشد . -A ابتدا محلول 2/0 ملكول گرم در لیتر 2ME در آب مقطر تهیه می كنیم (68/0 میلی لیتر مركاپتو اتانول در 0 5 میلی لیتر آب مقطر) سپس به تعداد نمونه های سرم مورد آزمایش لوله همولیز در نظر گرفته ودر هر لوله 3/0 ملی لیتر سرم فیزیولوژی + 2/0 میلی لیتر سرم بیمار + 5/0 میلی لیتر محلول مركاپتو اتانول می ریزیم . -B لوله را بمدت یكساعت در اتو 37 درجه قرار میدهیم تا مركاپتو اتانول بر روی IgM اثر نماید. -C لوله هارا از اتو خارج ساخته و برای هر نمونه سرم به مانند سرو آگلوتیناسیون در لوله تعداد مورد نیاز لوله همولیز در نظر می گیریم و رقتهای سریال (serial dilution) تهیه می كنیم بدین ترتیب كه به استثنا لوله اول ( كه لوله حاوی سرم و مركاپتواتانول می باشد ) در تمام لوله ها 5/0 میلی لیتر سرم فیزیولوژی می ریزیم سپس از محتوی لوله اول 5/0 میلی لیتر به لوله دوم می ریزیم و پس از مخلوط كردن از لوله دوم 5/0 میلی لیتر به لوله سوم انتقال می دهیم. این عمل را تا لوله ما قبل آخر ادامه می دهیم و از این لوله5/0 میلی لیتر دور ریخته می شود. ( لوله آخر به عنوان كنترل است كه فقط حاوی سرم فیزیولوژی وآنتی ژن خواهد بود )رقت های نهایی از 1:10تا 1:5120 خواهد بود . -D به هر لوله مقدار 5/0 میلی لیتر از همان آنتی ژن سرو آگلو تیناسیون لوله ای می ریزیم (یا آنتی ژن مخصوص 2ME ساخت انستیتو پاستور) -E لوله هارا به مدت 24-20 ساعت در اتو 37 درجه قرار می دهیم و سپس لوله هارا از نظر وجود آگلو تیناسیون بررسی می كنیم. پس از تاثیر 2ME بر روی سرم آگلوتینین های با ماهیت IgM حذف می شوند و چون آگلوتیناسیون مورد مشاهده تنها ناشی از وجود IgG است لذا تیتر IgG موجود در سرم را نشان می دهد . ضمنا توصیه می شود كه محلول رقیق شده 2ME در روز مصرف تهیه شود و تامپون مصرفی بدون فنل مورد استفاده قرار گیرد . بطور معمول تیتر قبل از درمان 1:40 به بالا در آزمایش2- مركاپتو اتانول مثبت تلقی شده ضمن آنكه هر تیتری در این آزمایش و بویژه تیتر 1:20 می تواند نشانه ای از آلودگی بوده مگر این كه خلاف آن ثابت شود . آزمایش آنتی هیو من گلو بو لین (( كومبس رایت )): روش آزمایش : به منظور انجام این آزمایش به ترتیب زیر عمل می شود : 1- رقتهای سرم مورد آزمایش مشابه روش سرو گلوتیناسیون در لوله با سرم فیولوژی یا بافر فسفات با 2/7 = PH به حجم 5/0 میلی لیتر تهیه شود . 2- آنتی ژن رایت به نسبت توصیه سازنده با سرم فیزیولوژی رقیق شود و سپس به حجم 5/0 میلی لیتر به هر لوله اضافه گردد. 3- لوله ها را به مدت 24 ساعت در گرمخانه 37 درجه سانتیگراد قرار داده و پس از این مدت نتیجه را قرائت نمایید . 4- پس از ثبت نتایج ، تمام لوله ها ئیكه دارای آگلو تیناسیون كامل یا جزیی باشند كنار گذاشته شود. 5- بقیه لوله ها را به مدت 10 دقیقه با دور 2000 در دقیقه سانتریفوژ نموده و مایع رویی را با دقت جدا نموده و دور بریزید و رسوب را با یك میلی لیتر بافر فسفات یا سرم فیزیولوژی مخلوط و مجددا سانتریفوژ كنید . 6- مرحله سانتریفوژ را 3 مرتبه تكرار نمایید . 7- رسوب نهایی را با 9/0 میلی لیتر بافر فسفات یا سرم فیزیولوژی و 1/0 میلی لیتر آنتی هیومن گلوبولین مخلوط و به مدت 24 ساعت در گرمخانه 37 درجه قرار دهید . 8- پس از انقضای زمان مذكور نتایج واكنش را قرائت كنید . در بروسلوز مزمن و طولانی ممكن است IgM دیگر تولید نشوند و آنتی بادی IgG و كلاس های IgG1 و IgG2 كه بیش از 80% IgG موجود را تشكیل می دهد نیز سنتز نگردد. و تنها آنتی بادی ضد بروسلایی موجود شامل IgG3و IgG4 باشد كه از نظر كمی و كیفی خیلی ضعیفتر از IgG1 و IgG2 و IgM ضد بروسلایی واكنش می دهند . توضیح اینكه این آنتی بادی ها در تست رایت نتیجه منفی كاذب بوجود می آورند ولی در صورت افزودن آنتی هیومن گلوبولین و انجام تست كومبس رایت نتیجه مثبت حاصل خواهد شد و در تست كومبس رایت تیتر قابل ارزش 40/1 به بالا می باشد و اگر علامتی از نظر بیماری نیز مشاهده شود نتیجه را با ارزش تر می نماید. (( طرز تهیه بافر فسفات با 2/7=PH و غلظت ده برابر بدین ترتیب است )) 1- فسفات مونو سدیك با دو ملكول آب =g 03/2 2- فسفات دی سدیك بدون آب = g 36/12 3- نمك طعام = g 80 را در یك ظرف یك لیتری ریخته و حجم می رسانیم و در موقع مصرف 1:10 رقیق می كنیم . لازم به توضیح است برای تشخیص آزمایشگاهی بروسلوز آزمایشهای مختلفی با حساسیتهای گوناگون به نامهای آزمون ثبوت مكمل ، آزمون هماگلوتیناسیون غیر مستقیم، آزمونهای ایمونواسی و روش الكتروفورز counter-current ((CIEP نیز انجام می گیرد.
موضوعات مرتبط: ايمونولوژي
آزمایش ویدال برای تشخیص سرولوژی بیماری حصبه ،Typhid وشبه حصبهِ Paratyphoid می باشد که علت انها آلودگی باسیلهای گونه سالونها Salmonella از دسته باسیلهای روده دای Entericbaciliمیباشد این با سیلها از راه دستگاه گوارش واردبدن انسان میشوند
این بیماری ها در اثر آلودگی با باسیل های گونه سالمونلادر انسان و موجوداتدیگر ازقبیل پرندگان و حیوانات خانگی و جوندگان ایجاد میگردد سالونلاها با سیل های گرم منفی غالبا متحرک هواز یا بی هوازی اختیاری فاقد اسپور هستند که از طریق خوردن آب و غذا – شیر گوشت وفراورده های حیوانی الوده به انسان منتقل میشوند –مگس وسوسک نیز از عوامل انتقال دهنده باکتری به مواد غذایی هستند حاملین باکنری (کسانی که میکروارگانیسم را برای مدت طولانی دفع می نمایند ) مهمترین منبع عفونت می باشند
بیماری هایی که توسط سالمونلا ایجاد می گردند :
تب های تینوئیدی و پارا تیفوئیدی که به نام تب روده ای (Entreic ferer ) معروف است
- سیستمی و عفونت خون Septicenia
- مسمومیت غذایی
باسیلهای تیفوئید و پاراتیفوئید را می توان قبل از این که تست ویدال مثبت شود به ترتیب از خون – مدفوع ادرا جدا کرد
روش تشخیص سرولوژیکی یا آزمایش ویدال
آزمایش ویدال برای اولین بار در سال 1896 توسط ویدال دانشمند فرانسوی ارائه شد اساس این آزمایش آلگوتیناسیون است بدین معنی که انتی بادیهای تولید شده در بدن علیه سمونلا که معمولا مدتی پس از شروع بیماری به وجود می ایند قادرند که با باکتری مربوط به آنتی ژن های مربوط به ان ترکیب شوند و ایجاد الگوتیناسیون نمایند البتهدر ازمایش کلاسیک ویدال خود میکروبسالمونلا بهعوان انتی ژنبه کارمی رفت وبعدار بر اثر مطالعات فایکس (Fellix ) و دیگر انتی ژن های مختلف سالمونلا کشف شدواستخراج گردیدند و امروزه به نسبت ویدال از این انتی ژن ها استفاده میشود .
آنتی ژن های سالمونلا
به طور کلی سه نوع آنتی ژن مختلف در سالمونلا وجود دارند که به نام های K- H –O- موردبررسی قرار میگیرند
آ«تی ژنo یالوماتیک مهبه حرارت 100 مقاوم است جنس آن لییویلی ساکارید است و در سطح باکتری و جود دارد و آناغلب از روش های غیر متحرک می سازند و غالبا در اواخر هفته اول بیماری آنتی بادی های ضد انتی ژن o در سرم ظاهر می گردد که به تدریج تیتر آن ها افزایش می یابد و در هفته ششم پس از الودگی به حداکثر تیتره می رسند و سپس به تدریج کاهش یافته پس از شش ماه تا یک سال به حداقل یا صفر می رسند وجود انتی با دی های صفر در سرم یک شخص مهمترین شاخص آلودگی اخیر و فعال در او می باشد تیتر بالا تر از 80/1 در مورد انتی ژن O می تواند تیتر بیماری زا یاشد مشروط به آنکه در آزمایش بار دوم که به فاصله یک یا دوهفته انجام می شود این تیتر افزایش قابل ملاحظه داشته باشد .
آنتی ژن H یاانتی ژن فلاژرکه نسبت به حرارت 60 درجه حساس است و مربوط به فلازل (تاژک) باکتری است جنس این انتی ژن از پروتئین است این آنتی ژن در سوش های متحرک و جود دارد آنتی بادی های ضدH غالبادر حدود دهمین تا دوازدهمین روز بیماری دور تر از انتی باد ی های ضدO در سرم بیمار ظاهر می گردند ولی بهسرعت به تیترهای بالاتری در مقایسه با انتی بادی های ضد O می رسند.
آنتی ژن H یک آنتی ژن پروتئینی است انتی بادی بر علیه این نوع انتی ژن از کلاس IgG است واین آنتی بادی ها ممکن است تا سالها در سرم باقی بمانند و وجود آنها دلیلی بر آلودگی اخیر و یک عفونت حاد نیست تیتر 60/1 به بالا در مورد آنتی بادیهای ضد H ارزش تشخسصی دارد پس از درمان یا واکسیناسیون این انتی بادی ها تاسالها در بدن قابل اندازه گیری هستند
آنتی ژن Vi criraence یا K
این آنتی ژن مربوط به کپسول باکتری است که به حرارت حساس است انتی ژن vi روی انتی ژن o را می پوشاند و مانع از اگلوتیناسیون باکتری به وسیله انتی بادی ضد o می شود باکتری هایی دارای انتی ژن vi از ویرولانس بیمارزایی بیشتری برخوردارند . تیتر آنها از نظر تشخیص دارای اهمیت نیست زیرا پس از انتی بادی های ضد o وH در سرم بیمار ظاهر می شود وغالبا در واخر هفتع دوم بیمار شروع به افزایش میکند و تا 40/1 میرسد و درافراد ناقل تیتر 10/1و 20/1 علیه آنتی ژن vi همچنان باقی می ماند .
موارد لازم برای انجام آزمایش :
- سرم بیمار را معمولا بدون از بین بردن کمپلان آن به کار می برند زیرا گاهی حرارت باعث پایین آوردن تیتر آگلوتینینها ی سرم می شود . سرم باید فاقد هر گونه ذرات و همولیز باشد و در صورتی که ذراتی در سرم دیده شود باید قبل از آزمایش آن را سانتریفیوژ کرد تا ذرات آن گرفته شود
- آنتی ژن مورد لزوم به طور استاندارد در دسترس می باشند قبل از مصرف باید شیشه آنتی ژ ن را به آرامی تکان داد تا ذرات آنتی زن به صورت سوسپانسیون یک نواختی در آیند . همیشه باید شیشه های محتوی آنتی زن در یخچال 2تا8 درجه سانتیگراد نگهداری شوند و هیچ وقت نباید دچار یخ زدگی شوند و قبل از انجام آزمایش باید شیشه های محتوی آنتی ژن را از یخچال بیرون آید تا به درجه حرارت آزمایشگاه برسند .
- سرم های کنترل :بهتر است در هر آ زمایش یک سرم کنترل مثبت و یک سرم کنترل منفی همرا با سرم بیمار آزمایش شود تا در صورتی که آنتی ژ ن دچار تغییراتی شده معلوم شود
- سرم فیزیولوژی : غلظت سرم فیزیولوژی برای رقیق کردن سرم معمولا محلول 5/8 گرم کلرسدیم در یک لیتر آب مقطرمی باشد.
تست سریع آگلوتیناسیون اسلایدی
طبق جدول زیر مقادیر مختلف سرم مورد آزمایش و آنتی ژن مورد نظر را در حضران یا دوایر اسلاید شیشه ای مخصوص اضافه نمائید .
شماره خطرات اسلاید | 1 | 2 | 3 | 4 | 5 |
میلی لیتر سرم مورد آزمایش | 08/0 | 04/0 | 02/0 | 01/0 | 005/0 |
مقدار آنتی ژنo یا H | یک قطره | یک قطره | یک قطره | یک قطره | یک قطره |
رقت سرم | 20 | 40 | 80 | 160 | 320 |
حدود تیتر آنتی بادی | 20/1 | 40/1 | 80/1 | 160/1 | 320/1 |
سپس توسط یک اپلیکاتور چوبی سرمو انتی ژن را به ترتیب از حفره شماره 5 به طرف حفر شماره 1 از رقیق تر به طرف غلیظ تر مخلوط نمایید و به اندازه یک دو ریالی آن را پهن نمایید و اسلاید را به آرامی حداکثر به مدت 3 دقیقه در دست حرکت دهید . سپس نتیجه آگلوتیناسیون هر رقت سرم را در زیر نور چراغ مطالعه مورد بررسی قرار دهید و شدت آگلوتیناسیون را با چشم غیر مسلح و بدون میکروسکوپ گزارش کنید مشابه همین روش را با سرم کنترل مثبت و منفی نیز تکرار کنید
لازم به ذکر است که سرم هر بیمار حداقل باید با آنتی ژن های o و H سه میکروب سالمونلا A,B,D آزمایش شود
- تیتر سرم ان رقتی از سرم است که در آن حداقل 50 درصد آنتی ژن آگلوتینه شده باشد
- نتیجه آگلوتیناسیون بر روی اسلاید باید بلا فاصله بعد از 3 دقیقه خوانده شود بعد از این مدت به علت خشک شدن انتی ژن و آ«تی بادی بر روی اسلاید و به هم چسبیدن ذرات آنتی ژن ممکن است نتیجه به طور کاذب مثبت شود
تفسیر نتایج
به طور کلی در تفسیر نتایج سنت ویدال بایستی همواره واکنش های متقاطع ، عفونت قبلی – واکسیناسیون قبلی را در نظر گرفت به طور کلی آنتی بادی های مر بوط به انتی ژن O زودتر از آنتی بادی های مربوط به آنتی ژن H ایجاد شده و زود تر نیز ناپدید میشود به طوری که پس از هر ماه تا یک سال تیتر آن کاملا کاهش می یابد
تیتر بالای Antio در سرم یک بیمار تب دار را می توان به عنوان نشانه ای از عفونت فعال دانست در حالیکه آنتی بادی های ضد H پس از تشکیل سالها در سرم بیمار باقی می ماند بنابر این چنانچه در یک بیمار تیترAntih مشاهده شد اهمیت و ارزش تیتر بالای Antio را ندارد زیرا ممکن است فقط نشان دهنده برخورد سالمونلا در گذشته باشد و یا در اثر واکسیناسیون تیتر Anti hبوجود آمده با شد تا یکسال ممکن است در سالمونولوز فقط تیتر anti h بالارود و لی تیتر anti o تغییر نکند
تیترآنتی بادی درهفته اول بیماربرای انتی ژن O,Hاز40/1تا160/1فراترنمیرودوبالارفتن تیتردرهفته های بعدازنظرتشخیص بیماری بسیارمهم است بطورکلی درایران ازمایش های مثبت باتیتر کمتراز80/1ارزش چندانی نداردوباید 2-1هفته بعدمجدداازمایش صورت گیرد
- ویروسهایی مانند E.B,V که باعث فعال شدن رده های مختلف سلولهای B Polycoiond activation می شوند سبب ایجاد پاسخ مثبت کاذب می گردند
- در سیروز کبدب آنتی بادی ضدo , H تولید میشود .
- درمان با انتی بیوتیک ها کلرامفنیکل موجب وقفه در آنتی بادی سازی می گردد . که پاسخ منفی کاذب خواهیم داشت در مواردی که نقص ایمنی وجود داشته باشد پاسخ منفی کاذب دیده خواهد شد.
موضوعات مرتبط: ايمونولوژي
متيونين خود يکي از اسيد هاي امينه ضروري بدن است که از طريق مواد غذايي مانند گوشت، پنير ،مرغ و .......وارد بدن مي شود که پس از جذب در بدن طي پروسه اي به فرم فعال يعني اس ـادنوزيل متيونين ـــمهم ترين جسم دهنده متيل ــ تبديل مي شود .
متيونين --------> هموسيستئين ----------> سيستئين
تبدیل هوموسیستئین به متیونین به کمک کوانزيم کوبال امين و اسيد فوليک صورت می گیرد ،بدین ترتیب که يک ريشه متيل به هوموسيستئين انتقال داده مي شود و هو مو سیستئین به متيونين تبديل مي شود , (s-ادنوزيل متيونين مهم ترين دهنده ي گروه متيل در تعداد زيادي از واکنش هاي بيو لوژيک مي باشد با کسب يک گروه متيل از 5-تترا هيدرو فولات هومو سيستئين به متيونين تبديل مي شود)و همچنينتبدیل هو مو سیستئین به سیستئین توسط انزیم سیستاتیون ـ بتا ـ سنتتاز صورت می گیرد , بدين صورت که هومو سيستئين با سرين توسط اين انزيم ترکيب شده و سيستا تيون تو ليد مي شود, که سيستا تيون توليد شده بصورت غير قابل برگشت تجزيه شده و به سيستئين و گلو تا تيون تبديل مي شود.
علل افزايش هومو سيستئين :
کمبود اسيد فوليک و کوبال امين و نقص در انزیم سیستاتیون ـ بتا ـ سنتتاز سبب افزايش ميزان هو مو سيتيئن درخون و ادرار مي شود.
هومو سيستئين پلاسما با بالا رفتن سن افزايش مي يابد و مقدار ان در مردان بيشتر از زنان داراي سن مشابه مي باشد. سطح هو مو سيستئين پلا سما تا سن 65-60 سالگي افزايش خطي نشان داده ولي بعد از اين سنين با شدت بيشتري افزايش يافته که اين افزايش به ازاي هر ده سال سن حدود 19% تا 1 ميکرو مول مي باشد.
در 15 - 5 درصد موارد فاکتورهاي ژنتيکي نيز دخالت دارند در بعضي از کشور هاي اروپايي ناقلان همو زيگوت يک واريانت حساس به دما از متيلن تترا هيدرو فولات ردوکتاز يافت شدند, که اين مسئله ناشي از يک موتاسيون نقطه اي در نوکلئوتيد667 ميباشد ,در اين افراد فعاليت انزيم ذکر شده به ميزان 70% کاهش مي يابد .ناقلان اين موتاسيون به ويژه به کمبود فو لات حساس بوده و يک افزايش 25 درصدي در هوموسيستئين پلا سما و ادرار دارند.
عوارض ناشی از افزایش هو مو سیستئین :
هو مو سیستئین هر چند که در متا بولیسم طبیعی بدن نقش دارد اما افزایش ان نیز خطراتی را ایجاد می کند ،هو مو سيستئين يک ريسک فاکتور است زیرا افزایش سطح ان با ساختار کلاژن تداخل می کند(کلاژن جزئی از استخوان ،بافت و غشای پایه عروق خونی است)
هو مو سیستئین سبب بروز بیماری های مختلفی می شود از جمله :اسیب به سطح داخلي عروق خونی به دليل توليد سوپر اکسيد و پراکسيد هيدروژن،تسهيل در تجمع پلاکتي(توسط فرم فعال هو مو سيستئين بنام تيو لاکتون هو مو سيستئين ايجاد مي شود) ،ايجاد اختلالات انعقادي و تشکيل لخته ،ايجاد تصلب شرايين ،کاهش عملکرد مغز در افراد مسن و اسیب به شبکیه چشم که بنا به گزارش ساینس دیلی،محققان با قرار دادن لایه های شبکیه چشم در معرض سطوح بالای هومو سیستئین در یافته اند شبکیه در این شرایط به شدت تخریب می شود.
بنا براین هو موسیستئین مرتبط با حمله قلبن ،سکته مغزی،الزایمر و از دست دادن بینایی است.
کاهش هو مو سیستئین:
استفاده از مواد غذایی که حاوی ویتامین های گروهB هستند مانند :غلات سبوس دار ،حبوبات ،سبزیجات برگی شکل..........واستفاده از مکمل های فولات مانند اسید فولیک ،B6,B12 هم چنین روی در کاهش هو مو سیستئین موثر هستند. روی مانند ویتامین های گروهB عامل ضروری برای درستی عملکرد انزیم های متابولیزه کننده هو مو سیستئین می باشد و از انجایی که بدن فاقد ذخیره روی است وجود ان در غذای روزانه(پسته،بادام،گوشت،گردو...) ضروری است
روش هاي اندازه گيري:
روش هلي متفاوتي وجود دارد ولي بهترين روش ها روش ايمنو لوژيک و تکنيک هاي ارزيابي معمولي بر پايه (کروماتو گرافي مايع با فشار بالا) مي باشد.
اين دو روش در بيماران هماهنگي خوبي را نشان مي دهد ,اما در اشخاص ممکن است تفاوت هاي قابل توجهي داشته باشد. به هر حال رويکرد معمول اين است که بعد از مرحله احيا هو مو سيستئين توتال پلاسما را که شامل فرم ازاد و فرم متصل به البومين است اندازه گيري مي شود.
موضوعات مرتبط: ايمونولوژي
البته RF که تست سرولوژیک استاندارد برای تشخیصRA به شمار میرود فقط 95-90% Specificity دارد (تنها در روش ELISA ، نه روشهای ضعیف تر دیگر مثل آگلوتیناسیون، نفلومتری و...). اما RF نوع IgM نه اختصاصی ونه جهت تشخیص RA کاملا حساس می باشد.
بنابراین تعیین آنتی بادی های Anti-CCP امکان تشخیص بهتر Early RA را از سایر پلی آرتریتهای التهابی(non-RA) فراهم می کند.
اگرچه حساسیت تست آنتی بادی CCP کمتر از RF(68% در مقابل 80%( می باشد، اما آنتی بادیهای ضدCCP در سرم خون بیماران RA که RF منفی باشند ، یافت می شود .
در کاربرد های کلینیکی ترکیب آزمایش Anti-CCP وRF حساسیت سرولوژیک تشخیص RA را بهبود می بخشد.
IU/mL 15 Anti-CCP> در سرم ، مثبت تلقی می شود.
سیستم اتوآنتی بادی های ضد CCP ، RA نوع مخرب (Erosive ) وسیربیماری خیلی شدید ارتباط فراوان دارد. بنابراین سیستم یاد شده می تواند در تصمیم گیری کلینیکی برای درمان RA ،تعیین کننده باشد .
نکته ظریف تر اینکه Anti-CCP در تعیین افراد مبتلا به RA حتی سالها قبل از شروع علایم و سینوویت مخرب می توان بکار برد (البته در حدود یک سوم موارد بصورت Predictor هستند).
مسلماً این پیشگویی ابتلا به RA، همراه در ترکیب با ارزیابی جهت سایر ریسک فاکتورهای پیدایش RA یعنی زمینه مساعد ژنتیک ، سابقه فامیلی مثبت و وجود سایر اتوآنتی بادیها موثرتر خواهد بود. نکته آخر اینکه تحقیقات اخیر نشان می دهد اگر طول مدت بیماری RA کوتاهتر باشد، با درمان سطح آنتی CCP بیشتر کاهش می یابد .
موضوعات مرتبط: ايمونولوژي
در بدن در پی هرگونه آسیبی که به رگها وارد شود سیستم انعقادی فعال شده و با مصرف پلاکتها و فاکتورهای انعقادی اقدام به تشکیل لخته و در نتیجه ممانعت از خونریزی از رگ اسیب دیده مینماید. از وظایف مهم سیستم انعقادی میتوان به هموستاز اشاره نمود. در واقع این سیستم در هنگام جراحت با فعال کردن ابشار انعقادی باعث تشکیل لخته شده و از طرفی با فعال کردن فاکتورهای ضد انعقاد مانند آنتی ترومبین و پروتئین C, S مانع از تشکیل بی رویه لخته میشود. ماحصل فالیت سیستم انعقادی در اثر فعال کردن ابشار انعقادی تشکیل فیبرین وشبکه فیبرینی در محل جراحت میباشد که این شبکه بعد از بهبود محل اسیب دیده توسط پلاسمین شکسته شده و از بدن حذف میگردد. حاصل عمل پلاسمین روی لخته فیبرین تولید قطعات کوچکی تحت عنوان کلی FDP یا محصولات تولید شده از تخریب فیرین میباشد که از جمله این محصولات میتوان به D-Dimer اشاره نمود. پلاسمین یک آنزیم فیبرینولیتیک بوده که روی فیبرین اثر گذاشته و با عمل فیبرینولیزی خود باعث شکست پیوند بیواحدهای E و D فیبرین شده و ایجاد D-Dimer و سایر FDP را میکند.
D-Dimer در حالت طبیعی در بدن غیر قابل ردیابی میباشد ولی در مواردی اندازه گیری D-Dimer افزایش در مقدار این محصول را نشان داده و از نظر بالینی مهم محسوب میشود. از این رو تست اندازه گیری D-Dimer به عنوان یکی از تستهای مهم آزمایشگاهی در آمده است.
موارد درخواست تست D-Dimer:
این تست در موارد شک به افزایش تولید لخته از جمله در موارد زیر درخواست میشود:
- ترومبوز در سیاهرگهای عمیق بدن ( VDT): در این حالت لخته های کوچکی بدون جراحت خاصی به عروق در سیاهرگهای نواحی عمیق بدن مثل پا تشکیل شده و باعث بروز علائمی مانند درد و تورم در پا و اسیب به بافتهای مجاور میگردد. از طرفی گاها این لخته ها حرکت کرده و به قسمتهای مختلف بدن واردمیشوند و علائم خاص محل را ایجاد میکنند از جمله در ریه ها ایجاد امبولی ریویPE ، در قلب باعث گرفتاری ماهیچه های قلب و یا دریچه های قلب و در مغز باعث عوارض مغزی ماننند سکته مغزی میکند.
- (PE ( Polmunary Embolism : در این حالت همانطور که قبلا ذکر شد لخته به ریه ها امده و ایجاد مشکلات تنفسی و درد در قفسه سینه میکند.
- DIC یا انعقاد منتشره داخل عروفی: این حالت به دنبال جراحی ها، عفونتهای سپتیک، سوختگی و یا در زنان باردا بعد از زایمان اتفاق می افتد که در این بیماری فاکتورهای انعقادی مرتب مصرف شده و باعث ایجاد لخته های ریز در کل بدن میشود و از طرفی عمل سیستم فیبرینولیتیک نیز فعال شده و باعث لیز لخته میشود که این افراد شدیدا مستعد خونریزی میباشند. در این افراد به دنبال بروز علائمی مانند تهوع، تشنج، خونریزی، درد شدید شکمی و ماهیچه ها و الیگوری تست D-Dimer همراه با تست PT, PTTو اندازه گیری میزان فیبرینوژن و شمارش پلاکتی درخواست میشود.
موارد مثبت کاذب این تست:
در جراحی، بارداری، تروما، عفونتها و التهابات شدید، ارتریت روماتوئید شدید، بدخیمی و بیماری های کبدی مقادی D-Dimer بدون ارتباط با وجود ترومبوز افزایش دارد.
موارد منفی کاذب:
در صورتیکه بر حسب اتفاق نمونه گیری در فاصله بسیار کمی بعد از تشکیل لخته در بدن انجام شده باشد این تست منفی میباشد. همجنین در صورت استفاده از آنتی کواگولان ها به دلیل جلوگیری از تشکیل لخته این تست منفی میشود. تاخیر زیاد در انجام تست نیز باعث بروز منفی کاذب میگردد.
موضوعات مرتبط: ايمونولوژي
هورمون محرک فولیکول (FSH)، توسط غده هیپوفیز در مغز ساخته می شود. کنترل تولید FSH، سیستم پیچیده ای است که هورمونهای تولید شده توسط غدد تناسلی (تخمدان ها یا بیضه)، هیپوفیز و هیپوتالاموس را درگیر می کند.
● اعمال FSH (هورمون محرک فولیکولی):
در مرد : اثر بر لوله های اسپرم ساز و تحریک ساخته شدن اسپرم
در زن : اثر بر فولیکول و تحریک ترشح استروژن از آن
FSH در زنان رشد و بلوغ تخمک ها در تخمدان در فاز فولیکولی سیکل قاعدگی را تحریک می کند. FSH در مردان بیضه ها را برای تولید اسپرم بالغ تحریک می کند و همچنین تولید پروتئین های متصل به آندروژن را پیش می برد. سطوح FSH در مردان پس از بلوغ نسبتا ثابت است.
در نوزادان و کودکان، سطح FSH در مدت کوتاهی پس از تولد افزایش می یابد، سپس تا سطوح بسیار پایین افت می کند (تا ۶ ماه در پسران و ۱-۲ سال در دختران). در حدود ۶-۸ سال، سطوح FSH دوباره قبل از شروع بلوغ و توسعه ویژگی های ثانویه جنسی افزایش می یابد.
● علت درخواست تست
این تست برای ارزیابی عملکرد هیپوفیز بیمار، شامل مسائل باروری، نارسایی غدد جنسی، مسائل دوران بلوغ یا تومورهای هیپوفیز؛ هنگامی که فرد دچار مشکل حامله شدن یا دوره قاعدگی نامنظم است؛ وقتی که پزشک فکر می کند که بیمار دارای علائم اختلالات هیپوفیز یا هیپوتالاموس است یا علائم بیماری تخمدان یا بیضه دارد؛ یا هنگامی که پزشک مشکوک شود که کودک بلوغ جنسی تأخیری یا زودهنگام دارد؛ در مردان و زنان، به عنوان بخشی از اقدامات لازم برای ناباروری و اختلالات هیپوفیز یا غدد جنسی؛ هنگامی که سیکل قاعدگی زن متوقف یا نامنظم شده، برای تعیین این که آیا زن وارد دوره یائسگی شده یا نه، درخواست می شود.
● در چه شرایطی تست افزایش می یابد
در زمان یائسگی، عملکرد تخمدانها متوقف می شود و سطح FSH افزایش می یابد. افزایش سطح LH و FSH در نارسایی اولیه تخمدان دیده می شود.
در مردان، سطح بالای FSH ممکن است نشان دهنده نارسایی اولیه بیضه باشد که می تواند به علت نقص در رشد بیضه یا آسیب بیضه باشد. بلوغ زودرس در نوجوانان سطح LH و FSH را افزایش می دهد. FSH با بالا رفتن سن و در افراد سیگاری افزایش می یابد.
● در چه شرایطی تست کاهش می یابد
سطوح پایین LH و FSH در نارسایی ثانویه تخمدان دیده می شود. بلوغ دیررس در نوجوانان سطح LH و FSH را کاهش می دهد.
● تست های تکمیلی
Total estrogens, Estradiol, LH, Testosterone, Progesterone
● طریقه جمع آوری نمونه
نمونه خون از طریق فروبردن سوزن داخل ورید بازو به دست می آید. گاهی اوقات نمونه ادرار تصادفی جمع آوری می شود، اما به دلیل ترشح چرخه ای FSH، ممکن است جمع آوری ادرار۲۴ ساعته درخواست شود. با اندازه گیری سطوح FSH تولید شده در طی یک دوره ۲۴ ساعته، تغییرات سطح FSH که در طول روز دیده می شود، می تواند به حداقل برسد.
● تداخلات دارویی
نتایج FSH می تواند با استفاده از سایمتیدین، کلومیفن، دیژیتالیس و لوودوپا افزایش یابد. نتایج FSH می تواند با قرص های جلوگیری از بارداری، فنوتیازین ها و درمان های هورمونی کاهش یابد.
● اطلاعات تکمیلی
FSH اغلب همراه با آزمایش های دیگر (LH، تستوسترون، استرادیول و پروژسترون) در اقدامات لازم برای ناباروری در مرد و زن، هر دو مورد استفاده قرار می گیرد. سطوح FSH همچنین در بررسی بی نظمی های قاعدگی و برای کمک به تشخیص اختلالات هیپوفیز یا بیماری های مربوط به تخمدان ها یا بیضه مفید هستند. سطح FSH برای کمک به تعیین علت تعداد کم اسپرم در مردان استفاده می شود.
در کودکان، FSH و LH برای تشخیص بلوغ تأخیری و زودرس استفاده می شود.
در زنان، سطوح LH و FSH می تواند به افتراق بین نارسایی اولیه تخمدان (نارسایی خود تخمدان ها یا عدم توسعه تخمدانها) و نارسایی ثانویه تخمدان (نارسایی تخمدان ها به علت اختلالات هیپوفیز یا هیپوتالاموس) کمک کند.
● آمادگی بیمار
آمادگی خاصی لازم نیست
● زمان نمونه گیری
نمونه خانم باید در زمان های خاصی از سیکل قاعدگی جمع آوری شود.
● نوع نمونه
نمونه خون از ورید بازو؛ گاهی نمونه ادرار تصادفی، یا ادرار ۲۴ ساعته
● تغییرات FSH در سیکل قاعدگی و اختلالات آن در ناباروری
در ابتدای سیکل قاعدگی (که با خونریزی همراه است) غدة آدنوهیپوفیز، هورمونهایLH [1] و FSH[2] را ترشح میکند. FSH با تأثیر بر سلولهای گرانولوزای فولیکولها، گامتوژنزیس را برای تکامل فولیکولها و تولید اووسیت تحریک میکند.
ترشح FSH تحت کنترل دو کمپلکس پروتئینی به نام اکتیوین[۳] وInhibin است. اکتیوین باعث تحریک و Inhibin سبب مهار ترشح FSH میشود. در زنان این دو ترکیب از تخمدان، غدة هیپوفیز و جفت ترشح میشوند.
در ابتدای فاز فولیکولار با تأثیر FSH روی سلولهای گرانولوزای فولیکولها، تولید Inhibin B افزایش مییابد. همزمان با افزایش Inhibin B، FSH در انتهای فاز فولیکولار کاهش مییابد و زمانى که تخمک آزاد مىشود میزان هورمون FSH کاهش بیشتری پیدا میکند (در این مرحله به احتمال زیاد Inhibin A مترشحه از جسم زرد نیز نقش دارد)، اما اگر تخمکى آزاد نشود، میزان این هورمون همچنان بالا مانده، احتمالاً هیپوفیز تلاش مىکند تا تخمدان را به این آزادسازى تخمک تحریک کند.
در انتهای فاز لوتئال، جسم زرد تحلیل رفته، تولید استروژن و پروژسترون کاهش و در نتیجه FSH افزایش مختصری مییابد (که به نظر میرسد نقش مهمی در آغاز سیکل بعدی داشته باشد). کاهش استروژن و پروژسترون (به ویژه استرادیول) در ابتدای سیکل قاعدگی سبب میشود اثر مهارکنندة ترشح FSH حذف و یک پیک افزایش FSH در روز سوم قاعدگی ایجاد شود.
وقتی قطر فولیکولها به حدود ۱۰-۸ میلیمتر میرسد (روز ۷- ۵ سیکل) تولید استروژنها به ویژه استرادیول به میزان قابل توجهی افزایش مییابد که به نوبة خود باعث رشد بیشتر فولیکول شده و از طرف دیگر موجب رشد و نمو لایة اندومتر رحم نیز میگردد. در ابتدا افزایش اندک در مقدار استروژن، مانع از ترشح بیشتر LH و FSH میشود، اما هرچه فولیکول به بلوغ نزدیکتر میشود، مقدار ترشح استروژن نیز بیشتر میشود.
پاسخ آدنوهیپوفیز به میزان بالای استروژن (در فاصلة روزهای ۱۲ تا ۱۳ سیکل قاعدگی) افزایش ترشح LH است که این کار را از طریق فیدبک مثبت بر هیپوتالاموس و افزایش ترشح GnRH[4] انجام میدهد. مکانیسم این تغییر فیدبک از منفی به مثبت تحت تأثیر استرادیول ناشناخته است.
همزمان با نزدیک شدن به حوالی دورة یائسگی، تخمدانها شروع به مقاومت در برابر هورمون FSH کرده و در نتیجه غدة هیپوفیز، FSH بیشتری تولید میکند تا سطح استروژن را بالا نگه دارد؛ این حالت سبب بینظمی سیکل قاعدگی شده و خونریزیهای شدید و غیر قابل پیشبینی در طول پریودها رخ خواهد داد.
عدم وجود پریود در یک سال و سطح FSH بالای ۳۰ تا ۴۰ mIU/mL نمایانگر آغاز دوران یائسگی است.
با توجه به اینکه میزان FSH در حوالی دورة یائسگی پر افت و خیز است، تنها یک نتیجة آزمایش FSHبرای تشخیص یائسگی کافی نیست. هورمون FSH در زنانى که ذخیرة تخمک در تخمدان آنها کم است نیز افزایش می یابد.
افزایش پایدار FSH نشانة آن است که فیدبک منفی نرمالی که از تخمدان صادر میشود وجود ندارد و در نتیجه LH و FSH افزایش مییابند. این یافته در یائسگی طبیعی است اما در سنین باروری غیر طبیعی بوده و نشانة موارد زیر است:
۱- یائسگی زودرس که به آن نارسایی زودهنگام تخمدان نیز گفته میشود
۲- اختلال مادرزادی در تشکیل گونادها مثل سندرم ترنر
۳- برداشت تخمدانها[۵] به روش جراحی یا اشعه
۴- سندرم سویر: زنانی با کاریوتایپ مردانه (XY) که مبتلا به نارسایی تخمدان هستند.
۵- سندرم شیهان (که نام دیگر آن سندرم سیموندزاست) و در آن به دلیل تشکیل لختة خون در عروق خونرسان به هیپوفیز، غدة مذکور نکروزه شده و از بین میرود و در نتیجه فرد به کمکاری ثانویه گونادی مبتلا میشود. این اختلال یکی از عوارض بارداری است که در اثر خونریزی زیاد در هنگام زایمان و یا DIC[10] ایجاد میشود.
۶- بعضی از انواع هایپرپلازی مادرزادی غدة آدرنال.
کاهش FSH نشانهای از نقص در عملکرد تخمدانها است که به آن هیپوگونادیسم میگویند. علامت اصلی کاهش FSH توقف خونریزی قاعدگی یا آمنوره است. وضعیتهایی که سبب کاهش ترشح LH میشوند عبارتند از:
۱- سندرم کالمن : یک اختلال ژنتیکی که با اختلال بویایی و هیپوگونادیسم همراه است
۲- مهار هیپوتالاموس
۳- کمکاری هیپوفیز
۴- اختلالات غذا خوردن : این اختلالات با عادات غیرطبیعی در غذا خوردن مشخص و در بزرگسالان به دو صورت مشاهده میشود: اختلال بیاشتهایی عصبی و اختلال پرخوری عصبی
۵- Female athlete triad : این اختلال ترکیبی از سه وضعیت اختلال در غذا خوردن، آمنوره و پوکی استخوان است که در بعضی زنان ورزشکار دیده میشود
۶- افزایش پرولاکتین خون
۷- فقدان ترشح گونادوتروپینها
۸- سندرم تخمدان پلیکیستیک
۹- مصرف ماری جوآنا که باعث مهار ترشح GnRH میشود.
۱۰- Gonadal suppression therapy: شامل دو دسته ترکیبات دارویی است که عبارتند از:
الف) GnRH antagonist: ترکیبات مشابه GnRH هستند که در اتصال به گیرندههای GnRH با هورمون فوق رقابت کرده و در نتیجه جلو فعالیت آن را میگیرند، مثل: ترکیبات تزریقی داخل عضلانی (Abarelix) و یا ترکیبات تزریقی داخل جلدی (Cetrorelix and Ganirelix)
ب) GnRH agonist (downregulation): این ترکیبات مشابه GnRH هستند و در ابتدا باعث افزایش گونادوتروپینها میشوند ولی از آنجا که اتصال آنها به گیرندههای GnRH به سرعت از بین نمیرود تقریباً بعد از ۱۰ روز سبب کاهش گونادوتروپینها میشوند (مثل: لوپرولید، بوزرلین، نفارلین، هیسترلین، وانتاس، گوزرلین و دزولورلین.
موضوعات مرتبط: ايمونولوژي
این آزمایش ها، حضور اتوآنتی بادی های ویژه تیروئید را تشخیص می دهند و مقدار آنها را اندازه گیری می کنند. اتوآنتی بادیها زمانی گسترش می یابند که سیستم ایمنی فرد، به اشتباه اجزای تیروئید را به عنوان خارجی (غیرخودی) شناسایی می کند و می تواند منجر به التهاب مزمن تیروئید (تیروئیدیت)، آسیب بافتی و اختلال عملکرد تیروئید شود.
در چه شرایطی تست افزایش می یابد
افزایش خفیف تا متوسط آنتی بادی های تیروئید، ممکن است در انواع اختلالات اتوایمیون تیروئید مانند سرطان تیروئید، دیابت نوع ۱، آرتریت روماتوئید، کم خونی مهلک و بیماری های عروقی کلاژن اتوایمیون یافت شود.افزایش قابل ملاحظه در غلظت، اغلب در بیماری های اتوایمیون تیروئید مانند تیروئیدیت هاشیموتو و بیماری گریوز دیده می شود.
در چه شرایطی تست کاهش می یابد
البته این آزمایش به نام های متعارف Thyroid autoantibodies; Antithyroid antibodies; Antimicrosomal antibody; Thyroid microsomal antibody; Thyroperoxidase antibody; TPOAb; Anti-TPO; TBII; Antithyroglobulin antibody; TgAb; TSH receptor antibody; TRAb; Thyroid stimulating immunoglobulin; TSI نیز خوانده می شود.
● علت درخواست تست
این تست برای کمک به تشخیص و پایش بیماری های اتوایمیون تیروئید و برای تشخیص آنها از اشکال های دیگر تیروئیدیت؛ برای کمک به راهنما در تصمیمات درمانی؛ هنگامی که فرد گواتر دارد و/ یا هنگامی که دیگر آزمایش های تیروئید، مانند T3 ،T4 و TSH اختلال عملکرد تیروئید را نشان می دهد؛ همراه آزمایش تیروگلوبولین زمانی که پزشک از آن به عنوان ابزار پایش استفاده می کند؛ در فواصل زمانی توصیه شده توسط پزشک، وقتی بیمار اختلال اتوایمیون تیروئید شناخته شده دارد، درخواست می شود.
اگر فرد با بیماری های اتوایمیون غیرمرتبط با تیروئید شناخته شده، نظیر لوپوس اریتماتوی سیستمیک، آرتریت روماتوئید یا کم خونی مهلک علائمی نشان می دهد که درگیری تیروئید را تداعی می کند، یک یا چند آزمایش آنتی بادی تیروئید نیز ممکن است درخواست شود .
● روش : الایزا
● اقدامات وابسته :
تنظیم دمای محیط ۲۰°c-25°c
بررسی انکوباتور و اندازه گیری دمای آن با دماسنج دستورالعمل کاربری انکوباتور
دستورالعمل کاربری دستگاه ELISA Reader
● هدف:
برسی و شناسایی بیماران با تیتر بیشتر از ۱:۱۰۰
بررسی سرطان تیروئیدو تشخیص بیماریهای تیروئیدی اتو ایمیون
موارد کاربرد:تیروگلوبولین ذخیره کننده ید است وبه سنتز هورمونهای تیروئیدی کمک می کند و درازمایشهای ایمنولوژی استفاده می گردد.
● موارد کاربرد:
این تست اساسا برای افتراق دادن بیماری های تیروئیدی نظیر تیروئیدیت هاشیماتو ،تیروئیدیت لمفوسیتیک مزمن در کودکان بکار می رود .چندین آنتی بادی علیه اجزای مختلف غده تیروئید وجود دارد .
آنتی تایروگلوبولین زمانی بروز می کند که تیروگلوبولین که خود بطور طبیعی در خون وجود دارد (همانند یک حامل هرمون تیروئید)ولی به عنوان یک آنتی ژن محرک سیستم ایمنی در غده تیروئید عمل نماید.بنابراین اتوآنتی بادی ها به وجود آمده و علیه تایروگلوبولین حاضر در سلول های تیروئید عمل می کند ،لذا التهاب و بنابر این تخریب تیروئید روی می دهد
اگر چه اکثر بیماری های تیروئید با افزایش سطوح آنتی تایروگلوبولین همراهند ولی تیروئیدیت مزمن (تیروئیدیت هاشیماتوز در بالغین،تیروئیدیت لمفوسیتیک در کودکان و بالغین جوان )شایعترین آنها اسی بمنظور اثبات تشخیص تیروئیدیت هاشیماتوز مقادیر آن باید بسیار بالا باشد .
این آنتی بادی فقط در قریب ۵۰% تیروئیدیت هاشیماتو مثبت می شود .هم هاشیماتو و هم تیروئیدیت لمفوسیتیک هر دو با سایر بیماری های اتوایمیون (کلاژن واسکولار)همراهند.
معمولا تیت آنتی تایروگلوبولین همراه با تست آنتی بادی آنتی تیروئید پراکسیداز انجام می شود .اگر هر دو انجام شود اختصاصیت و حساسیت نتایج افزایش می یابد
در صد ناچیزی از افراد دارای آنتی بادی های ضد تیروئیدی اند و بطور طبیعی سطوح آن در زنان از مردان بیشتر است
● اصول آزمایش:
نکات ایمنی:
استفاده از دستکش در حین انجام کار
ریختن سرسمپلرهای مورد استفاده در محلول حاوی دترجنت
دستورالعمل نگهداری نمونه و بایگانی آنها
پوشش مناسب
دستورالعمل کلی ایمنی و بهداشت کاری
صلاحیت و شایستگی کاربر:
کارشناس علوم ازمایشگاهی
دارای ۸ ماه سابقه ی کار در بخش الایزا
دارای مهارت در کار با سمپلر، تفسیرنتایج مثبت و منفی، رقیق سازی
آموزش در موارد ایمنی، مستند سازی، SOP دستگاه الایزا ، SOP انکوباتور
● نقش تشخیصی :
در بررسی سرطان تیروئید و حالات هیپرتیروئیدی مشکوک به اختلال تیروکسین خارج از موضع (ectopic )
بیماری های اتوماسیون تیروئید مثل هاشیمیتو و گریور نقطه مشترک این دو وجود اتوآنتی بادی علیه آنتی ژن تیروگلوبولین است .
بیماری های خود ایمنی در زنان بیشتر است و شیوع آنتی بادی ها با افزایش سن افزایش می یابد . مقادیر بالای این انتی بادی می تواند باعث تیروئیدیت مزمن و در نهایت هیپوتیروئیدی گردد . در ضمن افرادی که بیماری گواتر دارند غالباً آنتی بادی تیروگلوبولین در آنها بالا است . در بیماران جوان وجود گواتر به همراه مقادیر بالای آنتی تیروگلوبولین غالباً علامت بیماری هاشیمیتوز است که متعاقب آن کاهش فعالیت تیروئید و هیپوتیروئید ی وجود دارد . همچنینن در افراد مشکوک به سرطان تیروئید و افراد مشکوک به هیپر تیروئیدیسم مربوط به مصرف زیاد تیروکسین و تائید وجود تیروئیدیت مزمن که در بالا بیان شد به کار می رود .
● عوامل مداخله کننده:
فرهیحته آزمایشگاهی عزیز
شما در حال مشاهده نسخه نمایشی DEMO نرم افزار و مستندات می باشید
و به همین دلیل فقط قسمتی از مستندات برای شما قابل مشاهده می باشد
نتایج آزمایش و اهمیت بالینی:
افزایش سطح:
تیروئیدیت هاشیماتوز
آرتریت روماتوئید
بیماری روماتیسمی کلاژنی
آنمی پرنیسیوز
تیروتوکسیکوز
هیپوتیروئیدی
کارسینوم تیروئید
میکسودم
مستندات ( سوابق مورد نیاز جهت ردیابی، نگهداری و شناسایی عملکرد):
فرم Log Book
فرم درخواست کالا
دفتر کار
فرم کنترل دمای انکوباتور
فرم کنترل دمای محیط
فرم کالیبراسیون سمپلرها
پرینت دستگاه الایزا (نتیجه ی آزمایشات)
کنترل کیفی قبل از انجام کار و حین کار:
کنترل کیفی آب مقطر مورد استفاده (آب دیونیزه)
قرار دادن یک سرم مثبت در ران کاری و برخورد با آن همانند سایر نمونه ها
کنترل کالیبراسیون سمپلرهای مورد استفاده
● نمونه لازم:
۱ml از سرم بیمار که در کنار کیسه یخ ارسال می شود
سرم به حجم ۱۰λ
ظرف نمونه باید دارای نام کامل بیمار و شماره ی پذیرش آن باشد
● محدوده رفرانس :
الایزا
lu/ml
100> Neg
120-100 Bor
120 < pos
تفسیر ( علل تکرار، چگونگی و نحوه گزارش آن):
عدم قاطعیت در گزارش QC در حین کار (صحیح نبودن نتایج کنترل منفی و مثبت و استانداردها)
عدم انطباق نتیجه ی آزمایش با سابقه ی بیمار
در صورت بروز هرگونه نیاز به تفسیر در نتیجه ی کنترل کیفی با مسئول کنترل کیفی و یا مسئول فنی مشورت شود.
● زمان انالیز :
هفته ای یکبار
● آمادگی بیمار
آمادگی خاصی لازم نیست
● نوع نمونه
نمونه خون از ورید بازو
● تست های تکمیلی
T3; T4; TSH; Thyroglobulin
● طریقه جمع آوری نمونه
نمونه خون از طریق فروبردن سوزن داخل ورید بازو به دست می آید
● اطلاعات تکمیلی
اگر یک زن باردار بیماری اتوایمیون تیروئید شناخته شده (مانند تیروئیدیت هاشیموتو و یا بیماری گریوز) و یا یکی دیگر از اختلالات خود ایمنی را دارد و مشکوک به درگیری تیروئید است، یک یا چند آنتی بادی تیروئید ممکن است در اوایل حاملگی و سپس دوباره در نزدیکی پایان آن درخواست شود.
این تست ها برای کمک به پزشک در تعیین این که آیا نوزاد ممکن است در خطر ابتلا به اختلال عملکرد تیروئید باشد به کار می رود، چون آنتی بادی های تیروئید می توانند از جفت عبور کنند و باعث کم کاری یا پرکاری تیروئید در جنین یا نوزاد شوند.
اگر از آنتی بادی های تیروگلوبولین به عنوان ابزار پایش استفاده می شود و بالا مانده اند یا در ابتدا کاهش یافته اند، اما در طول زمان در حال افزایش هستند، پس این احتمال وجود دارد که درمان مؤثر نبوده و بیماری در حال ادامه است یا عود کرده است.
اگر میزان در حال کاهش است و یا به سطوح پایین یا غیرقابل شناسایی افت کرده، پس به احتمال زیاد درمان موثر بوده است.
درصدی از بیماران سالم، ممکن است برای یک یا چند آنتی بادی تیروئید مثبت شوند. رواج این آنتی بادی ها در زنان بالاتر است و با افزایش سن، افزایش می یابد.
موضوعات مرتبط: ايمونولوژي
گرچه در حال حاضر هیچ توافقی در مورد استفاده از این تست برای غربالگری مردان بدون علامت سرطان پروستات وجود ندارد، اما برای کمک به تعیین لزوم انجام بیوپسی از پروستات، برای پایش اثربخشی درمان سرطان پروستات و تشخیص عود سرطان پروستات؛ هنگامی که مردی دارای علائم مطرح کننده سرطان پروستات مانند ادرار کردن مشکل، دردناک و/ یا مکرر است؛ همچنین در طول درمان سرطان پروستات و پس از آن در فواصل منظم درخواست می شود.
غربالگری سرطان پروستات بهدنبال تشخیص بیماری، پیش از بروز هرگونه علامتی در فرد است. دو روش غربالگری که معمولاً در نبود علائم برای کشف سرطان پروستات بهکار میرود، یکی معاینۀ انگشتی مقعد است که پزشک پروستات را از طریق مقعد برای یافتن یک ناحیة تودهدار لمس میکند، و دیگری آزمایش خون است که ماده ساخته شدۀ پروستات را ـ که به آن آنتیژن ویژۀ پروستات (PSA) میگویند ـ اندازهگیری میکند.
این دو روش، همراه با هم، بسیاری از سرطانهای خاموش پروستات را که هیچ علامتی بروز نمیدهند، شناسایی میکنند. بهدلیل استفادۀ گسترده از آزمایش ٍِPSA در ایالات متحده، تقریباً ۹۰% سرطانهای پروستات در مرحلۀ اولیه مشخص میشوند و درنتیجه، پس از تشخیص، مردان زندگی طولانیتری خواهند داشت.
آزمایش PSA تام و DRE هنگامی که یک مرد علائمی دارد که می تواند به علت سرطان پروستات باشد درخواست می شود.
• توضیح راجع به تست PSA
PSA پروتئینی است که عمدتا توسط سلول ها در پروستات تولید می شود. بیشتر PSA به داخل مایع منی رها می شود، اما مقدار کمی از آن نیز به درون جریان خون رها می گردد. PSA به دو شکل در خون موجود است: آزاد (Free) و کمپلکس (cPSA، متصل به یک پروتئین).
اغلب از آزمایش PSA تام، که مجموع PSA آزاد و cPSA را در خون اندازه گیری می کند، استفاده می شود.
هنگامی که پزشک آزمایش PSA درخواست می کند، به PSA تام اشاره دارد.
در چه شرایطی تست افزایش می یابد
سطوح بالای PSA ممکن است در پروستاتیت و هیپرپلازی خوش خیم پروستات (BPH) و نیز با افزایش سن مردان دیده شود. انجام DRE، دستکاری پروستات توسط بیوپسی یا برداشتن پروستات، دوچرخه سواری، انزال در عرض ۲۴ ساعت قبل از آزمایش و عفونت پروستات می توانند سطح PSA را افزایش دهند.
• آمادگی بیمار
جلوگیری از انزال به مدت ۲۴ ساعت قبل از جمع آوری نمونه، چون انزال با افزایش سطح PSA مرتبط است
محدوده مرجع (نرمال رنج) وابسته به جنس زن/مرد
مقدار نرمال برای PSA تام، کمتر از ۴ng/ml (نانوگرم در هر میلی لیتر از خون) در نظر گرفته می شود.
• نوع نمونه
نمونه خون از ورید بازو
بهترین زمان نمونه گیری
• تست های تکمیلی
Digital Rectal Exam (DRE); Tumor markers
• طریقه جمع آوری نمونه
نمونه خون از طریق فروبردن سوزن داخل ورید بازو به دست می آید
• تداخلات دارویی
برخی داروهای شیمی درمانی مانند سیکلوفسفامید و متوترکسات، ممکن است باعث افزایش یا کاهش سطح PSA شوند.
• اطلاعات تکمیلی
نمونه باید قبل از این که پزشک آزمایش دیجیتالی رکتال (DRE) را انجام دهد و قبل از (یا چندین هفته بعد از) بیوپسی پروستات جمع آوری شود.
آزمایش PSA تام و DRE ممکن است برای غربالگری مردان بدون علامت و علامتدار برای سرطان پروستات مورد استفاده قرار گیرند. اگر این دو غیرطبیعی باشند، پزشک ممکن است این آزمایش را با بیوپسی پروستات و شاید آزمایش های تصویربرداری مانند سونوگرافی پیگیری کند.
اگر DRE طبیعی است، اما PSA کمی افزایش داشته، پزشک ممکن است آزمایش PSA آزاد درخواست کند تا نسبت این دو PSA را چک کند. این کار به تشخیص بین سرطان پروستات و علل غیرسرطانی دیگر که PSA را افزایش می دهند، کمک می کند.
توصیه می شود که پزشکان تست های PSA تام و DRE را به طور سالانه برای تمام مردان، از سن ۵۰ سالگی به بعد و برای افرادی که احتمال خطر بیشتری برای ابتلا به سرطان پروستات دارند و مردانی که سابقه خانوادگی ابتلا به این بیماری را دارند، از سن ۴۰ یا ۴۵ سالگی به بعد درخواست کنند
• نکته :
محققان بر این باورند: تنها آزمایش PSA کافی نیست و باید متدی به نام شدت PSA وجود داشته باشد.
این متد میزان افزایش PSA بیمار را در طول مدت معینی در نظر میگیرد. هر چه سرعت این افزایش بیشتر باشد، سرطان بدخیمتر است و درمان سریع لازم مینماید اما هر چه سرعت این افزایش کمتر باشد، تنها مراقبت کامل و مناسب نیاز است.
محققان دریافتند: وقتی میزان PSA افزایش یافته و دو نشانه در طول یک سال قبل از عمل جراحی بوجود میآید یک نفر از شش نفر مبتلا در طول مدت هفت سال خواهند مرد.
آنها میگویند که فاکتورهای مستقلی مانند طول مدت وجود PSA میزان مصرف انرژی و کلسیم آن روی شدت PSA تاثیری میگذارند و اگر به این فاکتورها توجه نشود خیلی از بیماران به این سرطان مشمول درمانهای جدی شدند.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
تب مالت بیماری عفونی است و عوامل ایجاد کننده آن در انسان کوکوباسیل گرم منفی میباشد که شامل:
۱- بروسلا B-Melitensis که بیشتر در بز ،گاو و گوسفند و مسئول اکثر موارد تب مالت در ایران می باشد.
۲- بروسلا B-Abortus در گاو
۳- بروسلاB-Suis در خوک
۴- بروسلا B-Canis در سگ ایجاد بیماری می کند.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
كاربردهاي روش الكتروفورز بر روي ژل در ابتدا محدود به موارد خاصي بود؛ زيرا دسترسي كاوشگرهاي (پروبهاي) ملكولي به پروتئينهاي جداسازي شده در بستر ژل بسيار دشوار بود. سرانجام Towbin و همكاران در سال 1979، روشي را ابداع كردند كه توانايي انتقال پروتئينها از ژل به غشاي جاذب را ميداد. اين روش به وسترن بلاتينگ يا بلاتينگ پروتئين معروف شد. اين تكنيك ابتدا در آزمايشگاه George Stark در استانفورد ابداع شد. نام وسترن بلات از جانب W.Neal Burnette به اين تكنيك اختصاص يافت و در حقيقت بيشتر يك شوخي و مزاح با اسم تكنيك ساترن بلات (Southern blot) بود كه به منظور بررسي DNA، پيشتر توسط Edwin Southern نامگذاري شده بود. تكنيك بررسي RNA را نورترن بلات (Northern blot) مينامند.
ه
موضوعات مرتبط: ايمونولوژي
ادامه مطلب

لوپوس بیماری سیستم ایمنی بدن است که میتواند قسمتهای مختلفی از بدن رادرگیر کند، شامل : پوست،مفاصل ، قلب ، ریه ، خون،کلیه ها و مغز.
بیمارى
لوپوس اریتماتوى منتشر SLE که به اختصار لوپوس نامیده میشود از دسته
بیمارى هاى خود ایمنى است . لغت " منتشر " بدین معنى است که این بیمارى
قادر است قسمت هایى از بدن را درگیر سازد ." اریتماتو " به معنى قرمز رنگ
است که بخاطر هاله قرمز رنگ روى پوست گونه ها به این نام گذاشته شده است .
سیستم ایمنی بدن به صورت طبیعی،آنتی بادیهایی* دارد که این آنتی بادی ها علیه ویروس ها ودیگر مواد خارجی عمل میکنند.این موادخارجی درواقع بعنوان آنتی ژن * عمل
می کنند و اختلالات سیستم ایمنی بدن راسبب می شوند دربیماری لوپوس درواقع
سیستم ایمنی نمی تواند فرقی بین ماده خارجی و سلول ها و بافت خود بدن
بگذارد،درنتیجه به بافت خودی حمله می کند . این روند دلیل التهاب و درد و
صدمه، در قسمتهای مختلف بدن است .
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
در حال حاضر تست پوستی توبرکولین مانتو روش استانداردی برای تعیین آلودگی فرد با مایکوباکتریوم توبرکولوزیس می باشد. انجام مطمئن و خواندن صحیح تست پوستی نیازمند استاندارد کردن روشهای کار، آموزش، نظارت و تمرین است.
تست توبرکولین با تزریق ۱/۰ میلی لیتر از PPD به قسمت داخلی ساعد صورت می گیرد.
تست پوستی توبرکولین (TST)، برای تشخیص عفونت سل نهفته (LTBI) سال ها مورد توجه بوده، اما بدلیل وجود اشکالات فراوان چون گذشته، بعنوان روش استاندارد طلایی مورد توجه نیست.
در همین راستا مطالعه ای با هدف بررسی توانایی تست (Quanti FERON TB Gold In Tube Test(QFT بعنوان تست اختصاصی جایگزین تست پوستی توبرکولین، جهت تشخیص عفونت سلی نهفته در گروه پرخطر از نظر ابتلا سل توسط سید مهدی هاشمی شهری و همکارانش انجام شد.
این مطالعه مقطعی با حجم نمونه ۱۳۴ نفر در بین پرسنل بیمارستان بوعلی زاهدان انجام شده است. آزمایشات TST و QFT برای آنها انجام شد.
معیار مثبت بودن تست TST، سفتی ≤۱۵میلیمتر بود و نتایج تست QFT نیز بر اساس دستورالعمل سازنده کیت تفسیر شد. رگرسیون لجستیک چندگانه جهت بررسی فاکتورهای خطر در مثبت بودن تست ها استفاده شد.
نسبت کارکنان مبتلا به سل نهفته عبارت بود از ۱۱۱ نفر (۸۲.۸ درصد) یکی از دو تست مثبت و در ۷۶ نفر (۵۶.۷ درصد) هر دو تستشان مثبت بود. همخوانی بین دو تست بالا بود. سابقه ابتلا خانوادگی به سل به عنوان عوامل موثر در مثبت بودن هر دو تست، از نظر آماری معنی دار بود.
نتایج مطالعه بیانگر شیوع بالای عفونت نهفته سلی در بین کارکنان بیمارستان و همخوانی بالای دو تست بود. تصمیم گیری مبنی بر انتخاب یکی از دو تست بسیار وابسته به جمعیت مورد مطالعه، هدف مطالعه و منابع موجود است.
با توجه به نتایج، تست کوانتی فرون می تواند جایگزین مناسبی برای تست پوستی در گروه پر خطر ابتلا به سل باشد.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
پوست دچار اگزما ، خشک ، دارای ترک و همراه با خارش بوده و ممکن است ترشح داشته و سطح آن مرطوب باشد، گاهی سطح پوست مبتلا ، دارای شوره یا پوسته نیز هست. خاراندن پوست با دست و ناخن آلوده باعث عفونی شدن موضع میشود.
اگزما با توجه به محل تماس پوست با مواد حساسیتزا در نقاط مختلفی از بدن بروز می کند. اگزما میتواند در سنین مختلف و حتی در دوران کودکی نیز بروز کند. این عارضه خارشدار پوستی ، به هیچگونه واگیردار نبوده و به دیگران سرایت نمیکند. حتی در یک بیمار نیز شدت آن ممکن است از یک روز تا چند روز دیگر و از یک محل تا محل دیگر متفاوت باشد.
▪ از جمله شایعترین بیماری های پوست اگزماها هستند که نوعی پاسخ التهابی پوست به یکسری عوامل داخلی و خارجی بدن می باشد و در همه سنین از نوزادی تا کهنسالی دیده می شود و دارای تظاهرات مختلفی می باشند .
▪ علائم شایع بیماری بصورت ضایعات قرمز پوسته دار خارش دار و گاهاْ دارای ترشح آبکی چسبناک می باشند که با توجه به مراحل مختلف بیماری هر یک از علائم فوق می تواند غالب باشد .
▪ عواملی نظیر زمینه ارثی ، بعضی عوامل قارچی و میکروبی ، تغییرات فصلی و آب و هوایی ، گرد و غبار ، پاک کننده های صابونی و غیرصابونی ، مواد شیمیایی ، برخی گیاهان و مصرف برخی داروها بصورت موضعی یا خوراکی می توانند در ایجاد یا تشدید این بیماری نقش داشته باشند .
● موارد زیر مثالهایی از انواع شایع اگزماها هستند :
▪ اگزمای ناحیه قنداق در نوزادان و شیرخواران
▪ اگزمای دست خانمهای خانه دار
▪ اگزمای ناشی از تماس با فلزات بدلی که بعلت حساسیت به آلیاژ نیکل رخ می دهد .
▪ اگزمای دست در کارگران ساختمانی که با سیمان سروکار دارند و بعلت حساسیت به کرومات میباشد .
● اگزمای پا ناشی از تماس با چرم کفش
▪ اگزمای ناشی از حساسیت به نوعی قارچ مخمری که بصورت شوره و قرمزی سر و ضایعات قرمز و پوسته دار صورت تظاهر می کند .
▪ اصول کلی درمان اگزماها شامل پرهیز از عوامل ایجاد کننده و تشدید کننده و مصرف داروهای لازم تحت نظر پزشک می باشد .
▪ باید توجه داشت که در بعضی از انواع اگزماها ممکن است بیماری برای سالیان متمادی به درجاتی ادامه داشته باشد .
عوامل بروز اگزما :
موادی که بطور شایع موجب بروز یا شدت یافتن اگزما میشوند عبارتند از:
لوازم آرایشی و بهداشتی و دارویی
• لوازم آرایشی ، بهداشتی معطر
• عطر ، ادوکلن و …
• لوازم آرایشی _ بهداشتی محرک (رنگ مو) ….
• صابونهای معطر
• لوازم آرایشی و بهداشتی غیر استاندارد.
• مواد شوینده پاک کننده مانند پودرها و مایعات که برای شستشوی ظروف و
لباس مورد استفاده میشوند. این مواد علاوه بر ایجاد حساسیت پوستی ، زمینه
بروز سرطانهای پوستی را نیز میتوانند فراهم کنند.
مواد شیمیایی و سنتتیک
لاستیکها:
مواد موجود در لاستیکها ، موجب بروز التهاب و اگزما در پوست میشوند. از
تماس پوست با این مواد باید دوری کرد در صورت امکان ، در زیر دستکش
ظرفشویی ، دستکش نخی ضد حساسیت باید پوشید. دستکشهایی که از جنس لاتکس
ساخته شدهاند میتوانند عامل بروز حساسیت پوستی باشد. حساسیت به این نوع
دستکش ، بویژه در میان کارکنان بهداشتی- درمانی و بیمارستانها دیده میشود.
مواد سوختی:
تماس مستمر پوست بدن با موادی چون نفت و بنزین ، زمینه بروز اگزما را فراهم میسازد.
گاز فرمالدئید:
این گاز از چسب و لوازرمی چون مبلمان چوبی آزاد و متصاعد میشود. و
میتواند به بروز ضایعات اگزمایی منجر شود. این گاز باعث تحریک چشم ، بینی
و گلو (ریزش اشک ، آبریزش از بینی ، عطسه ، سرفه و غیره) شده و همچنین
سردرد و حالت تهوع نیز ایجاد میکند.
فلزات:
امروزه استفاده از وسایل فلزی روکش شده با نیکل و کروم ، بسیار رواج دارد.
لوازمی مانند سنجاق قفلی ، زیپهای فلزی ، دکمههای فلزی ، قلاب کمربند و …
همگی با فلز حساسیتزای نیکل روکش شده است و یکی از مهمترین عوامل بروز
اگزما و تشدید آن ، به ویژه در خانمها محسوب میشوند. زیورآلاتی که به
تازگی با عنوان نقره آلمانی ، سیلور و تیتانیوم به فروش میرسند، دارای
مقادیر قابل توجهی فلز نیکل بوده و موجب بروز اگزما میشود. و در صورتی که
مزمن شود، ممکن است به سایر نقاط پوست نیز سرایت کند. توجه به محل بروز
حساسیت و وسیلهای که بطور مستقیم با آن ناحیه در تماس بوده برای تشخیص
این نوع حساسیت بسیار موثر است. و گاهی فلزاتی مانند طلا و نقره نیز
میتوانند عامل بروز اگزما باشند.
مواد موجود در محیط
گرد و غبار منزل (که بعضا حاوی مواد دفعی جانور بسیار کوچکی با نام مایت
Mite میباشد) در صورت تماس با پوست و به ویژه پوست دست ، موجب بروز اگزما
و یا بدتر شدن آن میشود. سیمان و سایر مواد مشابهی که در ساختمان سازی به
کار میروند و برخی از گیاهان نیز از جمله این مواردند.
مواد غذایی
تماس پوست بدن با موادی چون عصاره گوجه فرنگی میتواند به بروز اگزما و
یا بدتر شدن آن منجر شود برخی از مواد خوراکی نظیر آجیل و مغزها (مغز فندق
، بادام زمینی و غیره) تخممرغ، گندم، شیر، یا غذاهای دریایی
,میتوانند به بدتر شدن اگزما کمک کنند.
سایر عوامل
* استرس
* سابقه بیماری آلرژیک مثل تب یونجه، آسم، یا واکنش دارویی
* پارچههای دوخته شده از الیاف مصنوعی که عرق بدن را به دام اندازند.
* تغییرات شدید آب و هوا از نظر رطوبت، سرما یا گرما (خصوصاً وقتی تعریق زیاد شود).
در نهایت یکی از عوامل مستعد کننده بروز اگزما ، شستشوی مکرر دست با موادی چون صابون است. این مواد با از بین بردن چربی طبیعی و لایه محافظ پوست ، موجب حساس شدن پوست بدن نسبت به مواد خارجی و مستعد کننده بروز اگزما میگردند. عدم استفاده از دستکش هنگام استفاده از این مواد ، علل شیوع اگزما در میان خانمهاست.
درمان
اصول کلی
* درمان مشتمل است بر رفع علایم و شناسایی و حذف علت
* پوشیدن لباس نخی گشاد برای کمک به جذب عرق
* حتیالمقدور به حداقل رساندن استرس
* کوتاه کردن مرتب ناخنها و به دست کردن دستکش نرم به هنگام
خواب برای جلوگیریی از خاراندن. توجه داشته باشید که خاراندن
اگزما را بدتر میکند.
* کمتر حمام بگیرید تا از خشکی زیاد پوست اجتناب شود. صابون و آب
ممکن است باعث شعلهور شدن بیماری شوند. به هنگام حمام گرفتن، از
صابونهای غیر چرب مخصوص و آب ولرم استفاده کنید. نواحی ملتهب را
صابون نزنید.
* پس از حمام بلافاصله از کرم نرم و مرطوبکننده استفاده کنید.
* از قرار گرفتن در معرض تغییرات دمایی شدید (سرما یا گرمای زیاد) خودداری کنید.
* از هر چیزی که قبلاً بیماری را بدتر کرده است اجتناب کنید.
* از دستگاه مرطوب ـ خنککننده هوا برای افزایش رطوبت هوای خشک داخل منزل استفاه کنید.
داروها
پمادهای حاوی قطران یا داروهای کورتیزونی برای کاهش التهاب. اگر
پماد شبانه استفاده شود و پس از مالیدن آن، روی ناحیه با پلاستیک
بسته شود، شاید اثر بهتری حاصل شود.
آنتیهیستامینها برای کم کردن خارش
آنتیبیوتیک در صورت وجود عفونت
ندرتاً خوابآورها یا آرامبخشها
موضوعات مرتبط: ايمونولوژي
بیماری منییردر سال ۱۸۶۱ برای اولین بار توسط Prosper meniere مجموعة علائمی توضیح داده شد که منشا آن لابیرنت بود. سپس در سال ۱۹۲۶ Portmann ، منشا منییر را افزایش فشار ساک اندولنفی مطرح نمود و اولین جراحی آندولنفی را انجام داد. در مطالعات بعدی وجود پر فشاری یا هیدروپس در سیستم ساک اندولنفی ثابت شد.
مینیر در سنین ۲۰ تا ۶۰ سالگی بیشتر رخ میدهد. ابتلای هر دو گوش به این عارضه یکسان است، اما بیماری در ۲۰ درصد موارد دو طرفه است.
سن شیوع آن معمولاً ۲۰ تا ۶۰ سالگی است و نسبت ابتلای مردان به زنان بیشتر است. ابتلای هر دو گوش به این عارضه یکسان است، اما بیماری در ۲۰ درصد موارد دو طرفه است.
علل
علت بیماری هنوز ناشناخته است، اما احتمالاً عواملی مانند اثرات هورمونی و مواد عصبی- شیمیایی غیرطبیعی بر جریان خون، واکنشهای آلرژیک، بیماریهای خود ایمنی و سابقه خانوادگی مثبت در بروز این بیماری موثر هستند.
● علائم
علایم این بیماری ناشنوایی حسی- عصبی متغیر و پیش رونده، وزوز گوش یا احساس صدای بلند در گوش، احساس پری یا سنگینی در گوش، احساس سرگیجه شدید همراه با استفراغ یا تهوع است.
ولی سه نشانه سرگیجه شدید، وزوز گوش و ناشنوایی حسی- عصبی از مهمترین علائم ابتلا به سندرم منیر است.
سرگیجه معمولاً مشکل اصلی بیماران است، با این حال تا به حال هیچ آزمون تشخیصی قطعی برای این بیماری یافت نشده است.
● درمان
درمان در بیماری منیر ابتدا به صورت درمان طبی و دارویی و نهایتاً درمان جراحی است.
از نظر درمان بهتر است به بیمار اطمینان و آرامش دهیم. تجویز یک آرامبخش گاهی به بهبود بیماری کمک میکند. اعتقاد بر این است که غذای فرد بی نمک باشد و به جای نمک طعام از کلرور پتاسیم یا کلرور آمونیوم استفاده شود. گاهی اسیدنیکوتینیک نیز مؤثر است. برخی داروهای گروه آنتی هیستامین نیز ممکن است مؤثر واقع شوند.
البته همه این موارد بعد از معاینه بیمار بایستی توسط پزشک معالج و در صورت لزوم تجویز گردد.
رژیم غذایی در این زمینه توصیه میشود که در آن مایعات، محدود نیست، اما از آشامیدن آب به مقدار زیاد خودداری شود. پروتئین محدود نیست، اما کلسیم در موارد نیاز و سدیم خوراکی بسیار کم مصرف شود. تمام غذاها بدون نمک مصرف شوند و از تخم مرغ، گوشت و نان بی نمک میتوان به طور دائم در رژیم غذایی استفاده کرد.
در صورتی که به درمانهای دارویی پاسخ منفی داده شود و حملات ناتوان کننده سرگیجه ادامه یابد، از درمان جراحی استفاده میشود.
هنگام سرگیجه فرد باید بنشیند یا هنگام درازکشیدن، چشمها را باز نگه دارد و به یک نقطه خیره شود.
حملات سرگیجه ممکن است بین چند دقیقه تا حتی چند ساعت طول بکشد و با وزوز گوش و کاهش شنوایی همراه باشد. شروع سرگیجهها ناگهانی است و گاهی شدت سرگیجه به حدی است که بیمار قادر به راه رفتن و ایستادن نیست.
همچنین تشویق بیمار به نوشیدن مایعات و پرهیز از مواد کافئیندار مانند نوشابهها، قهوه، چای پررنگ و نهایتاً بهبود وضعیت روانی و اجتماعی در این بیماران با انجام اقدامات موثر توصیه میشود.
● زمینههای بروز یا تشدید بیماری
- آلرژی
– اختلالات متابولیکی مثل دیابت
- اختلالات عروقی مانند میگرن
- عفونتهای ویروسی
- سیفلیس گوش
برای از بین رفتن سرگیجه و احتمال سقوط نکات زیر رعایت شود
در هنگام سرگیجه، دو بالش را در دو طرف سر قرار دهید و چشمهای خود را ببندید و در محیطی آرام و مناسب قرار بگیرید.
نکاتی جهت کاهش تهوع و استفراغ
- مصرف داروهای ضد تهوع با تجویز پزشک
- رعایت رژیم غذایی
● چند نکته
- در این بیماری، اختلال هوشیاری و سردرگمی غیرعادی است. در صورت وجود این علائم باید به فکر علت دیگری بود.
- در این بیماری سرگیجه به صورت ناگهانی بروز میکند که در فواصل نامنظم به مدت چند ساعت رخ میدهد.
- عدهای از بیماران دچار اختلال حرکتی و عدم تعادل میشوند.
- وزوز گوش، کوتاه مدت و نوسان دار است.
- معمولاً یک گوش را درگیر میکند.
- شانس ابتلا در هر دو گوش یکسان است.
● ارتباط سندرم منیر و قند خون
به طور طبیعی مایع موجود در گوش داخلی، در دو حفرهی بالونی شکل قرار دارد. کار این مایع، کمک به درک وضعیت سر در فضا است. این کار توسط مجموعهای از گیرندههای گوش داخلی که به حرکت حساس هستند انجام میشود.
بیماری منیر، تعادل مایع در گوش داخلی را به هم میزند. این مایع ایجاد فشار میکند که سرانجام موجب پارگی پردهی ظریف گوش داخلی میشود. آیا میدانید چرا؟
تحقیقات اخیر نشان داده است که بین مقدار قند خون و سندرم منیر رابطه وجود دارد.
انسولین، هورمونی است که مقدار قند خون را کنترل میکند. پزشکان دریافتهاند که این بیماران در خونشان انسولین زیاد دارند که بر اثر آن اختلال در گردش خون پدید میآید. به علاوه غذای ناکافی، استعمال دخانیات، نوشیدن الکل و زیاد بودن کلسترول خون، باعث این بیماری میشود.
وقتی شما قند فراوان مصرف میکنید، قند خونتان به سرعت بالا و پایین میرود، آن وقت گوشهای شما نمیتوانند خود را با نوسانات قند خون در بدنتان منطبق کنند و در نتیجه شنواییتان کاهش مییابد.
از طرفی دیگر، مصرف قند باعث افزایش چربی خون شده و چربی خون باعث غلیظ شدن خون میشود و ورود خون را به شریان باریکی که به گوش داخلی خون میرساند مختل میسازد، بنابراین بهترین شیوهی درمان، کنترل قند خون است .
موضوعات مرتبط: ايمونولوژي
تب مالت بيماري عفوني است و عوامل ايجاد كننده آن در انسان كوكوباسيل گرم منفي ميباشد كه شامل:
1- بروسلا B-Melitensis كه بيشتر در بز ،گاو و گوسفند و مسئول اكثر موارد تب مالت در ايران مي باشد.
2- بروسلا B-Abortus در گاو
3- بروسلاB-Suis در خوك
4- بروسلا B-Canis در سگ ايجاد بيماري مي كند.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
نفلومتری ، سنجش ایمنی بر اساس پراکندگی نور
در نفلومتری برای سنجش کدورت محلول، پرتو نوری در طول موج خاص به آن تابانده و از روی میزان پراکنش نور در یک زاویه، خاص، اندازه گیری انجام می شود.
تحلیل گرهایی که به روش نفلومتری ، سنجش های ایمنی را انجام می دهند، غلظت پروتئین های ویژه سیستم ایمنی (آنتی ژن ها و آنتی بادی ها) و یا داروها را با اندازه گیری مقدار نور پراکنده شده از کمپلکس های مربوطه به سیستم ایمنی اندازه می گیرند. در این مقاله با اصول عملکرد این سیستم ها آشنا می شویم.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب

همان طوركه مي دانيم در تكنیک ELISA پروئين ها در سطح حفرات پليت پوشش داده مي شوند و در انتهاي آزمايش ELISA ،از
يك واكنش رنگ زا براي شناسايي انجام واكنش يا عدم انجام آن استفاده مي
شود.اما در وسترن بلات ابتدا پروتئين توسط الكتروفورز روي ژل اكريل اميد
جدا شده، سپس توسط جريان الكتريكي به غشاء نيترو سلولوز انتقال داده مي
شوند. اين غشا شبيه به كاغذ معمولي است، اندازه حفرات آن كاملا مشخص است و
توانايي زيادي در اتصال به پروتئين دارد پس از اينكه پروتئين به غشاء
نيتروسلولوز انتقال داده شد بقيه مراحل شبيه به ELISA طي
مي شود با اين تفاوت كه مسير حركت هر نمونه به شكل يك نوار بريده مي شود و
درون ظزف خاصي كه شيار هايي به اندازه نوار بريده شده، قرار مي گيرد و
بقيه مراحل در اين ظرف انجام ميگيرد . به اين ترتيب به طور مثال اگر نمونه
كشت ويروس HIV در اختيار داشته باشيم، بايد ابتدا انرا الكتروفورز نماييم. پس از الكتروفورز باندهاي پروتئيني را به gp۴۱ و gp۱۲۰
هر يك بنا به اندازه مولكول آن ها ، روي ژل تفكيك مي شوند .اكنون باندهاي
پروتئين را به غشاي نيترو سلولز انتقال داده تا مراحل بعدي به راحتي صورت
گيرد .
پس از اينكه پروتئين ها به غشاي نيترو سلولوز منتقل شدند، مرحله بعدي ميتواند به دو گونه طراحي شود :
الف) بعضي از مواقع هدف شناسايي پروتئين خاص در پروتئين هاي الكتروفورز شده است. اين حالت بيشتر در تحقيقات كاربرد دارد .
ب)
در برخي موارد نيز مخلوط پروتيني ماهيت مشخصي دارد و حتي وزن مولكولي
پروتئين هاي اين مخلوط و موقعيت آن ها پس از الكترو فورز مشخص مي باشند.
در اين موارد مي توان حضور آنتي بادي عليه پروتئين هاي را در سرم مورد
آزمايش بررسي نمود. در اكثر موارد تشخيص از اين روش استفاده مي شود. به
طور مثال پروتئين هاي ويروس HIV الكتروفورز
شده، سپس به غشاي نيتروسلولوز منتقل مي شود. اكنون پس از مجاورت با سرم
انساني هدف آزمايش بررسي وجود آنتي بادي عليه پروتئين غشايي يا مركزي HIV است.
در اين مواقع علاوه بر حضور يا عدم حضور آنتي بادي اختصاصي مي توانيم مشخص
سازيم كه آنتي فرد عليه چه جزئي از عامل بيماري زا است .
به اين ترتيب موارد مثبت كاذب مشاهده شده در آزمون ELISA در
اينجا حذف مي شود و به طور اختصاصي واكنش دهي آنتي بادي ،مورد آزمون قرار
مي گيرد. در بسياري مواقع كه چندين بار (۲ تا ۳ بار) تست ELISA يك عامل عفوني خطرناك براي يك بيمار مثبت مي گردد، جهت تاييد تست الايزا از تست وسترن بلات استفاده مي شود نظير عفونت هاي HIV ، HTLV و HSV .
البته
امروزه براي بسياري از عفونت هاي ويروسي و باكتريايي تست تاييد وسترن بلات
موجود است. به لحاظ تكنيكي در مواردي كه هدف ارزيابي حضور آنتي بادي خاص
در يك سرم باشد، مراحل ذيل دنبال مي شود تا اينكه در انتها از طريق واكنش
رنگ زايي رسوبي، اتصال آنتي بادي به آنتي ژن مشخص گردد. از انجا كه جايگاه
حركت و قرار گيري آنتي ژن روي نوار نيترو سلولز مشخص است، مي توانيم
مشاهده واكنش رنگي را دليل بر اتصال آنتي بادي اختصاصي به آن آنتي ژن
بدانيم.

- الكترو فورز محلول پروتئين روي ژل پلي اكريل آميد در حضور سديم دو دسيل سولفات .
۲-اتقال باندهاي پروتئين جدا شده از ژل پلي آكريل آميد به كاغذ نيترو سلولز به وسيله جريان الكتريسيته .
۳-بريدنمسير حركت پروتئين ها روي كاغذ نيترو سلولز به شكل نوار .
۴-مجاور كردن اين نوارها با موادي نظير BSA۲% يا شير خشك بدون چربي تا اينكه ساير جايگاههاي كاغذ نيترو سلولز پوشش داده شود و پروتئين هاي مراحل بعدي آزمايش به آن متصل نگردد. در مواردي كه از كيت هاي تجاري استفاده مي شود ، معمولا نوار هاي بريده شده نيترو سلولز كه پروتئين ها به آن انتقال داده شده اند به همراه الگوي قرار گيري پروتئين ها در كيت وجود دارد. اين نوارها معمولا مراحل بلكينگ را نيز پشت سر گذاشته اند.
۵-در اين مرحله سرم مورد آزمايش با نوار نيترو سلولز مجاور مي شود. مدت زمان مجاور سازي مي تواند بين ۱ تا ۳ ساعت باشد.
۶-پس از چند بار شستشو نوار نيترو سلولوز (در همان شيار هاي مربوطه ) آنتي بادي ضد ايمونو گلبولين انساني كونژوگه شده با انزيم (در صورتي كه نمونه سرم مربوط به انسان باشد ) اضافه مي شود و پس از ۲-۱ ساعت (همراه با حركت دادن ظرف) نوارها ۳تا ۵ بار توسط بافر مخصوص شستشو مي شوند.
۷-با ريختن سوبستراي آنزيم بر روي نوار واكنش رنگي رسوبي در محل اتصال آنتي بادي ايجاد
مي شود كه مي تواند نشانگر حضور آنتي بادي عبيه آنتي ژن خاص باشد . نوع
سوبسترا به كار رفته وابسته به انزيمي است كه به انتهاي آنتي بادي ضد
ايمونوگلوبين انساني متصل است . در مواردي كه اين آنزيم Horse Radish Peroxdase باشد، سوبستراي بكار رفته مي تواند دي- آمينو بنزيدين و H۲O۲ باشد كه آنزيم با اكسيد كردن دي - آمينو بنزيدين ، رنگ قهوه اي تيره اي را در محل واكنش آنتي بادي - آنتي ژن رسوب ميدهد.
موضوعات مرتبط: ايمونولوژي
آمیلوئیدوز میتواند ناشی از علل متفاوتی باشد.از علل آمیلوئیدوز اولیه تولید غیر طبیعی ایمونوگلوبولینها است. آمیلوئیدوز ثانویه در میلوم مولتیپل، آرتریت روماتوئید، بیماری التهابی روده، تب مدیترانهای خانوادگی دیده میشود. آمیلوئیدوز ثانویه در بیماریهای عفونی مزمن مانند جذام و سل نیز دیده میشود.
آمیلوئیدوز فامیلی یک بیماری اتوزومال غالب است. آمیلوئیدوز پیری شایعترین علت کاردیومیوپاتی آمیلوئید در افراد مسن است. یکی از علائم این بیماری پارستزی (گزگز و مور مور شدن) انتهاهای اندامها ناشی از نوروپاتی متابولیک است
با رسوب پروتئین فیبرى آمیلوئید در یک یا چند نقطه از بدن مشخص مىگردد. تظاهرات بالینى بستگى به توزیع آناتومیک و شدت رسوب پروتئین آمیلوئید دارد و طیف بیمارى از رسوب موضعى کماهمیت تا درگیرى بالقوه هر یک از اعضاء با تغییرات پاتوفیزیولوژیک شدید مىباشد.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
احساس ناخوشی , بی اشتهائی , تب و ضعف عضلانی مفرط علایم بیماری ناتوان کننده ای است که اولین بار توسط مارستون در سال 1861 توضیح داده شد.
بروسلا ملی تنسیس در سال 1862 توسط بروس جدا شد.در سال 1862 نوکارد بروسلا آبورتوس
را به عنوان عامل سقط جنین در گاوها معرفی نمود. در سال 1897 هیوز نام تب مواج را برروی
آن نهاد.در سال 1914 بروسلا سوئیس از خوک جدا شد.بدلیل ارتباط بین این سه گونه وبه افتخار داوید بروس این جنس را بروسلا نامیدند.
طیف وسیعی از حیوانات اهلی و وحشی را آلوده می کند و توانیی انتقال به انسان را دارند.
بروسلا دارای 6 گونه ممیباشد.بروسلا ملی تنسیس که میزبان آن بز و گوسفند است ولی ممکن است
گاهی گاو را هم آلوده می کند. بروسلا آبورتوسآلوده کننده گاو است معمولا باعث سقط جنین می شود.
ولی گاها حیوانات دیگری مانند گوسفند, بز, اسب و سگ راهم آلوده می کند. بروسلا سوئیس خوک را آلوده می کند.بروسلا کانیس سگ را آلوده می کند و باعث التهاب اپیدیدیم و اورکیت در سگها می شود.سه گونه کانیس و اویس و نئوتومائه در موارد انسانی گزارش نشده است .
بروسلا ها باکتری های کوچک گرد یا بیضوی کوکوباسیلی گرم منفی و غیر متحرک می باشند. تولید
اسپور و کپسول و فلاژل یا فیمبریا نمی کنند.در بعضی منابع از وجود کپسول بسیارظریف در باکتری
تهیه شده از کشت تازه با رنگ آمیزی مناسب ذکر شده است.(2) بین 0.5 -0.7 میکرومترعرض و
0.6-1.5 میکرومتر طول دارند.به صورت تک , دوتایی, زنجیره های کوتاه یا خوشه های کوچک
دیده می شوند.(1و3)
در رنگ آمیزی گرم منفی هستند, معمولا به صورت دو قطبی رنگ نمی گیرند.اسید فست نیستند ولی دربرابر رنگ بری با اسید و بازهای ضعیف مقاومت نشان می دهند.یک روش تغییر یافته اسید فست
برای رنگ آمیزی جفت و اجزای دیگر سقط طراحی شده است.(3)
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
تست حاملگی:
آزمایش حاملگی یا اندازه گیریBetaHCG چیست و چرا این
هورمون تست می شود؟
هورمون های HCG - LH - FSH - TSH همگی از دو بخش یا Sub Unit تشکیل می شوند : آلفا و بتا که بخش آلفا در همه ی این هورمون ها مشابه است و
افتراق اینها از هم با بخش بتا صورت می گیرد .
از ملاقات اسپرم واوول تخمک لقاح پیدا میکند. تخمک لقاح
یافته به طرف رحم رفته ودر جدار آن لانه گزینی میکند.بین 10-3روز بعد جفت تشکیل
میشود. HCG ( هر دو بخش آلفا و
بتا ) توسط سلولهای تروفوبلاستیک جفت سنتز می شود و نیمه عمر آن 36 - 12 ساعت است
. مهمترین وظیفه این هورمون نگه داری از جسم زرد است که تولید استرادیول و
پروژسترون می کند .
مقدار این هورمون در حاملگی طبیعی از روز ششم تا دهم بعد از
لقاح در سرم مادر بالا میرود ( حتی گاه از روز سوم لقاح هم قابل شناسایی است. )
معمولا25 -20 روز پس از آخرین قاعدگی ( و نه زودتر از آن )
مقدار این هورمون در ادرار مادر به اندازه ای میرسد که قابل اندازه گیری باشد .
معمولاچه زمانی این تست انجام میشود؟
این هورمون در حاملگی طبیعی 4 - 6 هفته بعد از شروع بارداری
افزایش چشم گیر پیدا کرده وسپس کم کم افت پیدا می کند . اما در موارد حاملگی خارج
رحمی - حاملگی مولار- برداشت کل رحم - کورتاژ پس از حاملگی سیر نزولی سریعتر آن را
شاهد هستیم .
سایر کاربردهای تست حاملگی یا هورمون بتا اچ سی جی(Beta
H.C.G)
در مردان در موارد تشخیص تومورهای بیضه و نئوپلاسم آن
کاربرد دارد که همراه با آلفا فیتو پروتئین تست می شو د . در بعضی بدخیمی ها از
قبیل کوریوکارسینوما - امبریونال سل کارسینوما و نیز حاملگی خارج رحمی میزان
BeteHCG به شدت بالا می رود و اندازه گیری های مرتب آن برای سنجش
پاسخ بیمار به شیمی درمانی ضروری است
این آزمایش چه زمانی وبه درخواست چه کسی قابل انجام است؟
این آزمایش را هرزمان که مشکوک به حاملگی طبیعی ویا حتی
موارد خارج رحمی باشیم انجام دهیم و درخواست آن بوسیله خود بیمار هم قابل قبول است.
بعلاوه در موارد بدخیمی هائی که نامبرده شد ویا حین درمان
آنها نیز کاربرد دارد.(برای ارزیابی چگونگی پاسخ بیمار به درمان)
چه موقع فرد میتواند مراجعه کند؟آیا ناشتائی ویا سایر شرایط
دیگری باید رعایت شود؟
ناشتا بودن لازم نیست. مصرف آب مانعی ندارد و حتی قطع
داروهای دیگر فرد ضروری نیست.
این آزمایش باچه نمونه ای انجام میشود وچقدر طول میکشد؟
چون هورمون ابتدا در خون ظاهر میشود سپس بعد از شروع
متابولیزه شدن در ادرار آمده ودفع میشود پس آزمایش خون حساستر است وزودتر مثبت
میشود.درموارد حاملگی خارج رحمی هم که حتما باید خون تست شود.
مدت زمان آزمایش نیم ساعت است ودر هرساعت شبانه روز قابل
انجام میباشد.
=================
راهنما و روش انجام تست حاملگي نوار تست حاملگي موجود به
روش يك مرحله اي سريع و مطمئن براي تشخيص حاملگي بر اساس وجود اچ-سي-جي
(HCG) در ادرار يا سرم خون مي باشد. اين هورمون از جفت ترشح شده و
ابتدا در خون و سپس در ادرار انتشار مي يابد. پس از وقوع حاملگي( يك روز پس از عقب
افتادگي در سيكل ماهانه) در خون و ادرار ميزان هورمون به ۱۰-۵ واحد ميرسد كه اين
مقدار براي مثبت شدن تست كافي است. از آن پس ميزان هورمون بسرعت افزايش مي يابد.
جمع آوري نمونه و روش انجام : ادرار را در ظرف تميزي مانند
ليوان يكبار مصرف ( در هر ساعت از روز) جمع آوري نمائيد.
نوار تست را از پاكت خارج سازيد ئ تا خط مشخص
(MAX) در ادرار فرو كنيد. بطوريكه جهت پيكان بطرف ادرار باشد. سطح
ادرار نبايد از خط (MAX) عبور كند. سه
ثانيه صبر كنيد
سپس از ادرار خارج ساخته.. بطور افقي بر روي دهانه ظرف
ادرار بگذاريد.تست hcg
نتيجه:
بر حسب ميزان هورمون موجود در ادرار نتيجه مثبت بصورت ۲ خط
قرمز حدود ۴۰ ثانيه بعد ظاهر مي شود. تا پنج دقيقه اگر رنگي ظاهر نشد دليل بر منفي
بودن آزما يش است.ظهور رنگ
در فاصله ۵ تا ۱۰ دقيقه مشكوك بوده و چند روز بعد تكرار
شود. هر نتيجه اي بعد از ۱۰ دقيقه فاقد ارزش است.
مثبت: آشكار شدن دو نوار رنگي در نواحي كنترل و پائين تر از
آن
منفي: آشكار شدن تنها يك نوار رنگي در ناحيه كنترل
شدت رنگ بستگي به مدت زمان حاملگي دارد.تذكرات:
۱- تنها هنگام آزمايش پاكت باز شود و نوار فقط براي يكبار قابل استفاده است.
۲- پاكت كوچك همراه نوار حاوي ماده سيليكازل ( جاذب رطوبت) است كه بعنوان
نگهدارنده ميباشد..پس از باز كردن پاكت دور انداخته شود.
۳- بيماراني كه مبتلا به سرطان هستند تفسير تست بعهده پزشك متخصص ميباشد.
نکات مهم در مورد بارداری :۱-. اگر پریود های منظم دارید
(یعنی حداقل ماهی یكبار با یكی دو روز عقب و جلو پریود می شوید) و تصمیم به
بارداری دارید با تاخیر یك هفته ای پریود به احتمال قوی حامله هستید برای اثبات
این قضیه ساده ترین راه استفاده از Home Test(تست ادرار) است كه در خانه انجام می شود وروش آن روی جلد تست توضیح داده شده
است .(بهترین زمان برای انجام تست ادرار صبحگاه است چون میزان هورمونHCG در ادرار بیشتر از
ساعتهای دیگر روز است) روش مطمئن تر تست خون است كه با تجویز پزشك ذر آزمایشگاه
انجام میشود .
▪ فراموش نكنید كه یك كپی از آزمایش حاملگی را برای آلبوم
نوزاد نگه دارید
۲. بلافاصله بعد از قطعی شدن حاملگی قرص مترنا MATERNAاز داروخانه تهیه كنید وروزی یك عدد مصرف كنید
دوستانی كه در ایران هستند بایداسید فولیك را شروع كنند
● نكته:
حداقل ۲ تا ۳ ماه قبل از بارداری بهتر است از تركیبات اسید
فولیك استفاده شود تا مشكلاتی از قبیل سقط جنین یا منگولیسم ایجاد نشود. بررسیهای انجام شده
نشان میدهد اسید فولیك میتواند از تأخیر رشد جنین جلوگیری كرده و باعث بهبود رشد شود
▪بسیاری از متخصصین معتقدندكه هر زمان كه تصمیم به بارداری
داشتین MATERNAرا شروع كنید
وتا ۶ ماه بعد اززایمان ادامه دهید
▪ در ایران متخصین معتقدند كه اسید فولیك تا پایان ۳ ماهه اول
ادامه یابد و بعد از آن قرص آهن شروع شود تا ۴ الی ۶ماه بعد از زایمان
▪ بیمه مترنا را كاور نمی كند وبرای خرید آن احتیاج به نسخه
پزشك ندارد
▪ اسید فولیك و فروس سولفات در ایران هر دوبابیمه كاور می شود
۳.در همان ماههای اول یكسری آزمایشهای اولیه از جمله چك هموگلوبین, آهن, فریتین
و همچنین آزمایش ادرار برای رد عفونت و یكسری آزمایشات برای رد بیماریهایی مثل
سفلیس سرخچه و…
انجام می شود كه خوشبختانه هم در ایران روتین است هم در
كانادا (یادتون نره)!!!!!!!!!!!!
۴ . یكی دیگر از اقدامات اولیه تعیین سن حاملگی وتاریخ زایمان است
LMP:اولین روز آخرین قاعدگی است
Conception Date:روزتخمك گذاری و احتمالا روز لقاح است
Due Date:روز تولد نوزاد
برای محاسبه تاریخ زایمان هم می توانید از لینك زیر استفاده
كنید
LMP را وارد كنید تا جدول حاملگی شما را تر سیم كند
● یا
ا▪ ز فرمول زیر استفاده كنید
▪ روز ماه سالLMP را بنویسید ۷ روز به روز اضافه كنید ۳ماه
از ماه كم كنید ۱ سال به سال اضافه كنید
مثال LMPیك خانم 1389/4/5
است روز زایمان او 12فروردین 1390است گرفتین!!!!!!!!!!!!
سيكل قاعدگي (Menstrual cycle)
در دختران و زنهاي جواني كه ازدواج نكرده اند و يا از
روشهاي مختلف ضد بارداري استفاده مي نمايند، بطور متوسط هر 28 روز سيكلي تكرار مي
شود كه از آن تحت عنوان سيكل ماهانه يا سيكل قاعدگي، ياد مي شود. كه روزهاي پاياني
آن، با خونريزي همراه است. در طي سيكل ماهانه، يکسري تغييرات هورموني رخ مي دهد.
در نيمه اول سيكل(14 روز اول) هورمونهاي LH
و FSH توليد مي شوند. در
روز 14 (اواسط دوران قاعدگي)، هورمون LH ، در سطح بالايي توليد مي شود که باعث
تحريک تخمگذاري((Ovulation از فوليكول مي شود. پس از آزاد شدن تخمك، فوليکول، به جسم زرد تبديل شده و
شروع به توليد هورمون پروژسترون مي کند. هورمون پروژسترون با تاثير بر روي سلول
هاي ديواره رحم، باعث تکثير سلولهاي ديواره رحم شده و سبب مي شود تا سلولهاي
ديواره رحم، از نظر منابع غذايي، سرشار شوند. جسم زرد طول عمر کوتاهي دارد و با
تحليل رفتن جسم زرد، در واقع منبع توليد پروژسترون از بين مي رود. بنابراين ديواره
رحم ريزش پيدا کرده و وخونريزي شروع مي شود. بدين ترتيب دوباره سيكل قاعدگي تكرار
مي شود.
اگر در روز 14 كه تخمك گذاري انجام مي شود، اسپرم در مجاورت
تخمك قرار گيرد، تخمك بارور شده و سلول تخم ايجاد مي شود. سلول تخم شروع به تكثير
كرده و بلاستوسيتها را بوجود مي آورد. در اطراف سلولهاي بلاستوسيت، سلولهاي
تروفوبلاست و سلولهاي سنسي شيو تروفوبلاست بوجود مي آيند. سلولهاي سنسي شيو
تروفوبلاست، اولين سلولهايي هستند که هورمون hCG را توليد مي کنند. هورمون hCG توليد شده از
سلولهاي سنسي شيو تروفوبلاست، بر روي جسم زرد اثر گذاشته و از تحليل رفتن آن
جلوگيري مي كند. پروژسترون توليد شده از جسم زرد، بر روي سلولهاي ديواره رحم اثر
گذاشته و از ريزش آنها جلوگيري كرده و بدين ترتيب، زمينه را براي لانه گزيني و
شروع حاملگي آماده مي كند. در روز 22، لانه گزيني (Implantation) انجام مي شود و با تشكيل جفت، توليد هورمونهاي hCG و پروژسترون، توسط سلولهاي جفت انجام مي گيرد.
معمولاً هورمون hCG را مي توان، يک هفته بعد از تخمک گذاري يا 20 روز بعد از آخرين قاعدگي در سرم
يا ادرار شخص حامله پيدا کرد. توليد هورمون hCG توسط جفت در طول 9 ماه حاملگي انجام مي شود. اما ميزان توليد آن در ماههاي
مختلف حاملگي متفاوت است (نمودار 1). به اين ترتيب كه، مقدار هورمون
hCG، در ابتداي
حاملگي، کم و در روز 60 تا 80 (ماه دوم حاملگي) توليد hCG در حد بالايي انجام مي گيرد، و ممکن است تا Iu/ml 250 برسد. بعد از روز 60ـ80 توليد هورمون hCG کاهش مي يابد، طوري که در شروع 3 ماهه Trimester)) دوم حاملگي توليد هورمون hCG کاهش مي يابد، ولي
هيچ وقت صفر نمي شود. و تا آخر حاملگي، پيوسته به ميزان Iu/ml 15ـ10 توليد مي شود. تا اينكه، حدود دو هفته پس از زايمان طبيعي، در سرم ناپديد
شده و قابل تشخيص نمي باشد.
نمودار 1: تغييرات توليد هورمون hCG در طي حاملگي
هورمون hCG و تشخيص حالات
پاتولوژيك
علاوه بر اين كه مي توان با جستجوي وجود يا عدم وجود هورمون
hCG در نمونه ادرار، حاملگي را تشخيص داد، مي توان با اندازه
گيري مقدار هورمون hCG برخي حالات
پاتولوژيك را نيز تشخيص داد.
كاهش توليد مقدار هورمون hCG از ميزان طبيعي آن، مطرح كننده احتمال سقط جنين و حاملگي خارج رحمي(Ectopic
Pregnancy) مي باشد.
افزايش توليد غير طبيعي هورمون hCG از ميزان طبيعي (بيشتر از Iu/ml 250)، مطرح كننده احتمال بيماريها و تومورهايي نظير
کارسينوماي جفتي (Choriocarcinoma)، مول هيداتيديفرم
(Hidatidiform Mole) وكاريسنوماي اوليه تخمدان مي باشد.
بعلاوه اينكه در مردان مبتلا به تومورهاي بيضه (Testicular Tumor) و همچنين تومورهاي توليد كننده هورمون hCG مانند سرطان ريه (Lung Carcinoma)، از زنجيره بتاي هورمون
hCG به عنوان ماركر تومور استفاده مي شود.
روشهاي مختلف تشخيص و اندازه گيري هورمون
hCG
1) روش ممانعت از آگلوتيناسيون غير فعال ذرات لاتکس
Passive Latex Agglutination Inhibition Test
2) روش آگلوتيناسيون غير فعال ذرات لاتکس Reversed Passive Latex
Agglutination
3ـ روش اليزا ( (ELISA: Enzyme Linked
Immunosorbent Assay
4ـ روش آر. آي. اي (RIA: Radio Immuno
Assay) RIA: كه حساسترين و دقيق ترين روش است.
در بين چهار روش فوق، روش اول، در آزمايشگاههاي تشخيص طبي،
بيشترين كاربرد را دارد. كه در ادامه، روش انجام آن بطور مفصل بحث مي شود.
روش ممانعت از آگلوتيناسيون غير فعال ذرات لاتکس
آزمايش، با استفاده از کيت و در دو مرحله انجام مي شود.
اجزاي موجود در كيت عبارتند از:
1) قطره چكان حاوي کنترل مثبت (ادرار شخص حامله)
2) قطره چكان حاوي کنترل منفي (ادرار شخص غيرحامله)
3) قطره چكان حاوي آنتي بادي بر ضد زنجيره بتاي هورمون
hCG
4) قطره چكان حاوي ذرات لاتكسي كه بر روي آنها، زنجيره بتاي
هورمون hCG متصل شده است.
5) اسلايد زمينه سياه و اپليكاتور
روش انجام آزمايش
روش كيفي
بر روي اسلايد زمينه سياه، يک قطره از نمونه ادرار خانم، يك
قطره كنترل مثبت و يك قطره كنترل منفي را اضافه کرده و به هر كدام از آنها، يک
قطره آنتي بادي بر ضد زنجيره بتاي هورمون hCG اضافه مي كنيم. با اپليكاتور دو قطره را مخلوط كرده و حدود 30 ثانيه حرکت
دوراني مي دهيم. در مرحله دوم به هر كدام از مجموعه هاي مرحله اول، ذرات لاتکس را
اضافه كرده، دو دقيقه حرکت دوراني مي دهيم و جواب را آزمايش را از نظر آگلوتيناسون
بررسي مي کنيم.
پس از اين مدت در قطره مربوط به كنترل مثبت، ذرات آگلوتينه
مشاهده نمي شود ولي در قطره مربوط به كنترل منفي، ذرات آگلوتينه مشاهده خواهد شد.
در نمونه ادرار مورد آزمايش، اگر ذرات آگلوتينه مشاهده شد، نشان دهنده عدم وجود
هورمون hCG در نمونه ادرار، و
حامله نبودن شخص است. ولي اگر ذرات آگلوتينه مشاهده نشد، نشان دهنده وجود هورمون
hCG در نمونه ادرار، و حامله بودن شخص است.
روش كمي
گاهي اوقات لازم است مقدار نسبي هورمون
hCG را در ادرار محاسبه نمود. بدين منظور مي بايست ابتدا، نمونه
ادرار را در لوله هاي آزمايش، با سرم فيزيولوژي، به ترتيب 1/2، 1/4، 1/8 و غيره
رقيق كرد. سپس از هركدام از لوله ها يك قطره برداشته و بر اساس روش كيفي كه در
بالا توضيح داده شد، براي وجود يا عدم وجود هورمون hCG بررسي كرد. آخرين قطره اي كه در آن آگلوتيناسيون مشاهده نشود بعنوان تيتر
هورمون hCG آن ادرار در نظر
گرفته مي شود. در نهايت مقدار هورمون hCG از فرمول زير محاسبه مي شود.
V * D * S
V(Volume): حجم ادرار بر حسب ميلي ليتر، D(Denominator): مخرج كسر تيتر
هورمون، S (Sensitivity): حساسيت كيت
همچنين براي محاسبه مقدار هورمون hCG در ادرار 24 ساعته، كافيست ادرار 24 ساعته را در يك ظرف تميز جمع آوري كرده و
در فرمول فوق به جاي V عدد مربوط به حجم
ادرار 24 ساعته را قرار دهيد.
نكته ها
1) بهترين نمونه براي روش لاتکس، نمونه ادرار اول صبح است، چرا
كه در طول شب كمتر مايعات مصرف مي شود و 2) بنابراين ادرار غليظ بوده و غلظت مواد
موجود در آن، تقريبا برابر غلظت آنها در سرم مي باشد.
3) واژه هايي چون گراويندكس، تست حاملگي و يا پرگننسي
(Pregnancy)،
همگي به معناي آزمايش تشخيص حاملگي مي باشد.
گونادوتروپین جفتی، هورمونی برای مادر و جنین :
گونادوتروپین کوریونیک انسانی (hCG) یک گلیکوپروتیین است که تغییرات در جز کربوهیدراتی آن موجب تفاوت در خصوصیات
بیولوژیکش می گردد. همانند دیگر گلیکوپروتیین ها مانند FSH، LH و TSH گونادوتروپین کوریونیک انسانی از دو زیر واحد آلفا و بتا تشکیل یافته که در
هورمون های گلیکوپروتیینی، زیر واحد مشابه یکدیگر هستند، اما فعالیت بیولوژیک ویژه
هر کدام، هم چنین اختصاصیت در ایمونواسی ها، مربوط به تفاوت های مولکولی و
کربوهیدراتی زیر واحد های بتا است...
به نظر می رسد تمام بافت های انسانی hCG تولید می کنند، ولی جفت به لحاظ دارا بودن توانایی گلیکوزیله کردن این پروتیین
و در نتیجه کاهش میزان متابولیسم آن موجب فعالیت بیولوژیک آن به همراه نیمه عمر
طولانی اش می شود. تا به امروز تنها عملکرد شناخته شده hCG پشتیبانی از کورپوس لوتیوم است که حدود روز هشتم پس از تخمک گذاری و یک روز پس
از لانه گزینی (زمانی که برای اولین بار در خون مادر قابل ردیابی است) جای LH
را می گیرد. ادامه بقای کورپوس لوتیوم کاملا وابسته به
hCG است و در مقابل، بقای حاملگی تا هفته هفتم وابسته به
استرویید های کورپوس لوتیوم.
غلظت hCG در گردش خون مادر در
زمان شروع یک دوره خون ریزی قابل انتظار ولی اتفاق نیفتاده، تقریبا
L/IU 100 است. حداکثر میزان hCG در گردش خون مادر یعنی حدود IU/L 000/100، در هفته های
8 تا 10 لقاح ایجاد می شود. سپس میزان آن در هفته های 18 تا
20 به حدود IU/L 000/10 تا 000/20 کاهش می
یابد و تا هنگام ترم در همان حد باقی می ماند. دلیـل آنکه سطـوح
hCG در نیـمه دوم حـاملگی کاهـش می یابد، مشخـص نیست. در نزدیکی
ترم، سطوح hCG در زنانی که جنین
دختر دارند، بالاتر است. این مساله در مورد سطوح سرمی، محتوای جفتی، سطوح ادراری و
غلظت های مایع آمنیوتیک نیز صدق می کند.
در دو وضعیت بالینی، تیتر hCG خون به طور ویژه کمک کننده است: بیماری تروفوبلاستیک و حاملگی های نابه جا.
حدود 20 درصد بیماران مبتلا به مول هیداتی فرم دچار عوارض
بدخیم خواهند شد. به دنبال حاملگی های مولار، باید تیتر hCG در بیمارانی که بیماری ادامه دار ندارند، تا هفته 16 به مقادیر غیرقابل ردیابی
افت کند. در مقابل، بیماران مبتلا به بیماری تروفوبلاستیک، اکثرا تا هفته سه و
معمولا تا هفته شش دارای منحنی غیرطبیعی (تیتر بیشتر از L/IU 500) می باشند. زمانی تشخیص بیماری تروفوبلاستیک حاملگی داده می شود که میزان
hCG در یک بازه زمانی دو هفته ای ثابت مانده یا افزایش یابد، یا
افزایش مداوم آن 16 هفته پس از تخلیه دیده شود. پس از درمان، باید میزان آن
ماهیانه تا حداقل یک سال، سپس سالی دو بار و برای پنج سال متوالی اندازه گیری شود.
در واقع، تمام حاملگی های نابه جا با مقادیر قابل ردیابی
hCG همـراه هستند. مقادیر hCG در حاملگی های طبیعی و نابـه جا با سرعت های متفاوت افزایش می یابند و اندازه
گیری کمی hCG همراه با
اولتراسونوگرافی لگن تاثیر به سزایی بر تشخیص و کنترل حاملگی نابه جا دارد:
1) اندازه گیری کمی hCG می تواند حیات حامگی را ارزیابی کند، به طوری که سرعت افزایش طبیعی (حدود 50
درصد افزایش،هر دو روز یک بار) معمولا نشان دهنده یک حاملگی طبیعی است.
2) هنگامی که تیتر hCG از L/IU 1000 تا 1500 تجاوز می
کند، اولتراسونوگرافی واژینال باید بتواند وجود یک حاملگی داخل رحمی را تشخیص دهد.
3) مقادیر کاهش یابنده hCG با درمان موثر رخ می دهند، اما مقادیر ثابت و افزایش یابنده، نشان دهنده وجود
بافت تروفوبلاستیک زنده هستند.
● آزمون های مثبت کاذب
گاهی نتایج مثبت کاذب آزمون های hCG دیده می شوند و موجب درمان جراحی یا طبی نامناسب می گردند. در این موارد، سطح
hCG نسبتا پایین است (معمولا کمتر از
L/IU 150). علل مختلفی برای این وضعیت وجود دارند، از جمله
hCG ترشح شده توسط هیپوفیز، ولی معمولا این مشکل بالینی ناشی از
تداخل مواد دیگر با آزمون است، به ویژه آنتی بادی های ضد LH یا ایمونوگلوبین های anti-animal. به علاوه تومورهای غیرتروفوبلاستیک می توانند مقادیر قابل ردیابی
hCG را ترشح کنند. معمولا یک پاسخ مثبت کاذب در طول زمان ثابت
باقی می ماند (نه افزایش می یابد و نه کاهش). هنگامی که تابلوی بالینی نامشخص است
یا متناسب با نتایج آزمایشگاهی نمی باشد (به ویژه فقدان بافت تروفوبلاستیک)، hCG مثبت را می توان به چند روش تایید نمود:
1) اخذ نتیجه مشابه توسط یک روش دیگر
2) نشان دادن وجود hCG در ادرار
3) نشان دادن نتایج موازی با ترقیق های متوالی
hCG استاندارد و نمونه سرمی بیمار.
● گزارشی از یک مطالعه بالینی
▪ استفاده از مهارکننده آروماتاز و hCG برای آماده سازی آندروژنی پیش از IVF:
طی IVF، مقادیر اضافی FSH و LH برای تحریک هم
زمان چندین فولیکول تجویز می شوند. با دردسترس قرارگرفتن داروهای جدیدتر و فهم
بهتر دینامیک فولیکول، پروتکل های تحریک دستخوش پیشرفت های قابل توجهی شده اند و
مطالعات متعددی نیز برای ارزیابی ترکیب های دارویی جدید و استفاده از درمان های
جانبی برای بهبود تحریک فولیکولی انجام شده یا درحال انجام هستند.
آندروژن ها، علاوه براینکه پیش ساز سنتز استرادیول هستند،
اثرات چشمگیر دیگری نیز در مراحل اولیه توسعه فولیکولی دارند. هم چنین نشان داده
شده که درمان مکمل با آندروژن به شکل DHEA موجب بهبود نتیجه تحریک در بیماران poor-responder که تحت روش تحریک سازی برای IVF قرار می گیرند، می شود.
یک مطالعه تصادفی شده توسط لوسل و همکاران، احتمال همراهی
استفاده از مهارکننده های آروماتاز و hCG پیش از تحریک را با بهبود نتیجه نهایی، مورد ارزیابی قرار داده است.
مهارکننده های آروماتاز با جلوگیری از تبدیل آندروژن به
استروژن، موجب افزایش سطوح آندروژن موضعی می شوند و استفاده از
hCG نیز با تشدید سنتز آندروژن از طریق گیرنده LH، موجب ایجاد سطوح بالاتر آندروژن می
شود.
در گروه priming، آنتاگونیست GnRH با دوز 3 میلی گرم برای جلوگیری از توسعه اولیه فولیکولی داده شد، اما این
آنتاگونیست برای گروه کنترل پیش از تحریک تجویز نشد. سپس تحریک توسط دوز ثابت
اولیه گونادوتروپین ها در هر دو گروه انجام گرفت و سپس، تحریک توسط دوز متغیر
آنتاگونیست GnRH در هر دو گروه
ادامه یافت. خصوصیات پایه در هر دو گروه قابل مقایسه بودند.
در گروه priming مدت تحریک و مقادیر گونادوتروپین های مورد استفاده بیشتر بود. تعداد تخم ها،
رویان ها و رویان های با کیفیت بالا در هر دو پروتکل مشابه بودند و میزان بارداری
نیز تفاوتی نداشت. هم چنین در این گروه در روز اول تحریک، سطوح
FSH و LH پایین تر بودند.
این مطالعه نتوانست هیچ فایده ای برای آماده سازی پیش از تحریک توسط مهارکننده
آروماتاز و hCG پیدا کند.
برای این یافته ها می توان توضیحات احتمالی ارایه داد: اول
آنکه، علاوه بر تجویز مهارکننده آروماتاز و hCG، تفاوت مهم دیگری بین دو پروتکل وجود
داشت: به بیماران گروه priming سه روز پیش از تحریک، یک دوز 3 میلی گرم آنتاگونیست GnRH داده شد، از آنجایی که استفاده از آنتاگونیست GnRH موجب سرکوب شدید سطوح گونادوتروپین درون زاد می شود و گونادوتروپین های درون
زاد نیز با تامین نیاز اندک به حمایت LH به توسعه فولیکول کمک می کنند، اگر این هورمون ها سرکوب شوند، تخمدان ها ممکن
است پاسخ آهسته تری به تحریک دهند، یعنی یافته ای که در این مطالعه دیده شد.
همچنین این احتمال وجود دارد که مدت priming خیلی کوتاه بوده باشد. مطالعات دیگر که از اشکال دیگر priming مانند DHEA و
recombinant LH استفاده کرده اند، آنها را برای مدت های بسیار طولانی تری
تجویز نموده اند (یک هفته تا 2 تا 3 ماه). چنین priming طولانی ممکن است به خوبی از سوی بیماران مورد پذیرش نباشد، به ویژه زمانی که
نمی توان بهبود قابل توجهی را ضمانت نمود. برخی از گزارش های پیشین، بیماران
poor-responder را مورد مطالعه قرار داده اند (گروهی که کنترل آنها مشکل
است). این احتمال وجود دارد که آماده سازی توسط آندروژن می تواند اثر مثبتی بر
زنان
poor-responder داشته باشد.
موضوعات مرتبط: ايمونولوژي
 تاکنون
29 سیستم گروه خون انسانی ثبت گردیده که مهمترین آنها دو سیستم گروه خونی
ABO و Rh می باشند. دانسـتن گروه خونی هنگام دریـافـت و یـا پـیـوند عضـو
از اهـمیت بالایی برخوردار است. دریافت خون
تاکنون
29 سیستم گروه خون انسانی ثبت گردیده که مهمترین آنها دو سیستم گروه خونی
ABO و Rh می باشند. دانسـتن گروه خونی هنگام دریـافـت و یـا پـیـوند عضـو
از اهـمیت بالایی برخوردار است. دریافت خوننـامتـجــانس میتواند به واکنش شدید ایمنی و تخریب گسترده گلبولهای قرمز، افت فشار خون، نارسایی کلیوی، شوک، لخته شدن خون، حـمـله قلبی، آمبولی، سکته مغزی و حتی مرگ بیانجامد.
نکته: گروههای خونی در جانداران متفاوت می بـاشد، سـگ هـا 4 گروه خونی، گربه ها 11 گروه خونی و گاوها 800 گروه خونی دارند.
نکته:گروه خونی یک ویژگی وراثتی است و از والدین به ارث میرسد.
3 شکل ژن (آلل) مطابق شکل گروه خونی شما را کنترل میکنند. شما 2 آلل دارید که یکی را از پدر و دیگری را از مادر به ارث میبرید، که ژنوتیپ شما میباشد:

- AA یا iAo:گروه خونی A
- BB یا iBo:گروه خونی B
- AB:گروه خونی AB
- oo:گروه خونی O
بنابراین میتوان گروه خونی فرزندان را مطابق شکل پیش بینی کرد:

آنتی بادی یا پادتن یا آنتی کور یا ایمنوگلوبین (antibody/immunoglubin): پروتئین های Y شکلی میباشند، که سیستم ایمنی بدن برای شناسایی و خنثی کردن عوامل بیگانه مانند باکتریها و ویروسها از آنها استفاده میکند. هر آنتی بادی(پادتن) قادر به شناسایی یک آنتی ژن (پادگن) خاص میباشد.
آنتی ژن یا پادگن(ANTIGEN):ماده ای است که پاسخ ایمنی بدن را تحریک و تولید پادتن خاص خود را سبب میگردد.
ایمنوگلوبینهای (IgM):بزرگترین آنتی بادیهای بدن بوده که مسئول فرآیند آگلوتیناسیون(AGGLUTINATION) گلبولهای قرمز خون میباشند. هنگامی که دو گروه خونی نامتجانس با یکدیگر امتزاج می یابند، گلبولهای قرمز به هم چسبیده و به شکل توده در می آیند (دلمه میشوند). پادتن های ANTI-A و ANTI-B همان IgM میباشند.
آگلوتیناسیون(AGGLUTINATION):فرایند به هم چسبیدن و به شکل توده در آمدن گلبولهای خون و یا باکتریها ،در پاسخ به برخی آنتی بادیها.
آگلوتینوژن(AGGLUTINOGEN):همان آنتی ژن است.
آگلوتینین(AGGLUTININ): همان آنتی بادی است.
سیستم خونی ABO:
حضور و یا فقدان آنتی ژن های A وB روی غشاء خارجی گلبولهای قرمز(RBC) تعیین کننده گروههای ABO میباشند.
گروه خونی A:آنتی ژن A روی سطح گلبولهای قرمز حضور دارد،در خون آنتی بادی ضد B در گردش است.
گروه خونی B:آنتی ژن B روی سطح گلبولهای قرمز حضور دارد،در خون آنتی بادی ضد A در گردش است.
گروه خونی AB:هر دو آنتی ژن های A و B روی سطح گلبولهای قرمز حضور دارد،خون فاقد هرگونه آنتی بادیهای ضد A و B است.
گروه O:سطح گلبولهای قرمز فاقد هرگونه آنتی ژن های A و یا B است، اما در خون هر دو آنتی بادی های ضد A و B در گردش میباشند.

نکته: در ایران گروه خونی 38% افراد O،33% A،22% B و 7% AB میباشد.
نکته:سیستم ABO در شامپانزه ها و گوریل ها نیز وجود دارد.
سیستم (RHESUS) و یا فاکتور RH و یا آنتی ژن RH D:
چنانچه سطح گلبولهای قرمز فردی واجد این آنتی ژن(D) باشد، گروه خونی فرد RH+ و چنانچه فاقد این آنتی ژن باشد RH- میباشد، که در کنار سیستم ABO بصورت (+) و یا (-) نشان داده میشود. از آنجایی که نخستین بار در میمون (RHESUS) شناسایی گردید به این نام خوانده میشود.
نکته:85 تا 90 درصد ایرانیان RH+ میباشند.
پیش بینی گروه خونی فرزندان بر حسب آنتی ژن RH D:
چنانچه هر دو والدین RH+ باشند، فرزندانشان ممکن است RH+ و یا RH- شوند.
چنانچه هر دو والدین RH- باشند، فرزندانشان RH- خواهند بود.
چنانچه یکی از والدین RH+ و دیگری RH- باشد، فرزندانشان RH+ و یا RH- خواهند شد.
نکته:بنابراین مثلا حتی اگر گروه خونی پدر و مادر هر دو O+ باشد ممکن است فرزندی با گروه خونی O- بدنیا آورند.
اشخاص RH مثبت و RH منفی هیچکدام دارای آگلوتینین ضد D به طور طبیعی در پلاسمایشان نیستند، و آگلوتینین ضد D فقط در نزد اشخاص RH منفی در صورتی بوجود می آید که به آنها خون RH مثبت داده شده باشد. پس از یکبار انتقال خون RH مثبت، آگلوتینین ضد D در تمام طول زندگی شخص باقی خواهد ماند و این شخص دیگر نخواهد توانست خون RH مثبت دریافت کند. این موضوع فقط در مورد اشخاص RH منفی صدق میکند. افراد RH مثبت فاقد آگلوتینین ضد D در پلاسمای خود بوده، بنابراین میتوانند هم از خون منفی و هم از خون RH مثبت استفاده کنند.
RH مثبت و زنان:
در مورد مردان اگر RH منفی باشند، و بر اثر اشتباه به آنها خون RH مثبت داده شود، تنها ناراحتی که پیش می آید این است که آگلوتینین ضد D در آنها تولید میشود و از این به بعد انتقال خون باید محدود به خون RH منفی گردد.
در مورد زنان هرگز نباید در سنین باروری و یا جوانتر از آن آگلوتینین ضد D ایجاد شود. زیرا آگلوتینین ضد D ممکن است زن را از بدنیا آوردن نوزاد زنده محروم سازد.
1- چنانچه مرد با RH مثبت با زن RH منفی صاحب فرزند شوند، جنین ممکن است RH مثبت و یا RH منفی گردد(بسته به ژنوتیپ پدر).
2- چنانچه جنین RH مثبت باشد، از آنجایی که برخی سلولهای خونی جنین میتواند از جفت عبور کرده و وارد خون مادر گردد، در خون مادر آگلوتینین ضد D تولید خواهد شد.
3- در زایمان نخست مشکلی برای نوزاد پیش نخواهد آمد.
4- در بارداری های بعدی، چنانچه نوزاد RH مثبت باشد، آنتی بادیهای ضد D موجود در خون مادر، وارد گردش خون جنین شده و گلبولهای قرمز جنین را تخریب میکند. نوزاد بدنیا آمده در این شرایط دچار "بیماری همولیتیکی نوزادان" میشود. علایم این بیماری شامل: یرقان (به علت تجمع بیلی روبین در خون)، کم خونی، عقب ماندگی ذهنی، نارسایی قلبی، اشکال در تنفس، ادم شدید کل بدن، بزرگ شدن اندازه قلب، کبد و طحال و مرگ میباشد.
5- در چنین مواقعی برای نجات زندگی نوزاد تعویض خون (یعنی تخلیه کامل خون RH مثبت از بدن نوزاد و تزریق خون RH منفی به جای آن) انجام میگیرد.
6- با تزریق عضلانی آمپول روگام(RHOGAM) (که گاماگلوبولین ضد D میباشد) به مادر یکبار در هفته 28 م حاملگی و علاوه بر این، چنانچه نوزاد Rh مثبت باشد 72 ساعت پس از زایمان، میتوان از بروز این اختلال جلوگیری بعمل آورد. در این حالت آنتی بادیهای ضد D قبل از آنکه در خون مادر آنتی بادی ضد D تولید شود، اقدام به نابود کردن سلولهای RH مثبت می کنند. این آمپول در مادرانی استفاده می شود که Rh منفی هستند و همسرانشان Rh مثبت دارند.

سازگاری گروه های خونی:

- گروه خونی A:میتواند به گروه های AB و A خون اهدا کند و از گروه های خونی A و O خون دریافت کند.
- گروه خونی B:میتواند به گروه های AB و B خون اهدا کند و از گروه های خونی B و O خون دریافت کند.
- گروه خونی AB:تنها میتواند به گروه خونی AB خون اهدا کند ،ولی از تمام گروه ها ی خونی میتواند خون دریافت کند.
- گروه خونی O:به تمام گروه های خونی میتواند خون اهدا کند، اما فقط میتواند از گروه خونی O خون دریافت کند.

نکته:گروه خونی O- اهدا کننده عمومی و گروه خونی AB+ گیرنده عمومی نامیده میگردند.
نکته: در مواقع اورژانس که فرصت کافی برای شناسایی گروه خونی بیمار وجود ندارد، از گروه خونی O- برای بیمار استفاده میشود.
نکته: در دریافت پلاسمای خون شرایط عکس میشود. یعنی گروه AB میتواند به تمام گروه ها پلاسما اهدا کند، اما گروه O فقط میتواند به گروه خونی O پلاسما اهدا کند.

فراورده های خونی:
پس از اهدای خون، خون کامل (شامل قسمت سلولی+پلاسما) به اجزای خون تفکیک میگردند. یعنی گلبولهای قرمز، پلاکت ها، فاکتورهای انعقادی، پلاسما، آلبومین و ایمنوگلوبین ها. سپس هر کدام از این فراورده ها به بیماران بر حسب نیازشان داده میشود.مثلا گلبولهای قرمز به افرادی که در اثر آسیبها و عمل جراحی خون از دست داده اند، و یا دچار کم خونی هستند، داده میشود. و یا پلاسما عمدتا برای بیماران دچار سوختگی استفاده میگردد. بنابراین به ندرت خون کامل به بیمار تزریق میشود.
دو باور رایج اما غیر علمی:
1- به عقیده برخی گروه خونی ارتباط تنگاتنگی با شخصیت افراد دارد، به ویژه در کشور چین و ژاپن.
2- به عقیده برخی افراد بایستی رژیم غذایی خود را منطبق با گروه خونی خود انتخاب کنند .
موضوعات مرتبط: ايمونولوژي
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
آنتي بادي عليه محصول خارج سلولي استوپتوكوك يا هموليزليزينO است.
روش: اجراي يك تست سريع آگلوتيناسيون لاتكس روي اسلايد بطور شايعي يك روزه مورد استفاده مي باشد. روشهاي قديمي بر اساس رقيق نمودن داخل لوله همراه هموليز RBC بوده اند.واحد Todd بعنوان تصويري كه نشان دهنده هموليز داخل لوله بود به كار مي رفت . در حالي كه واحد بين المللي (IU) با استفاده از لاتكس سريع كه امروزه استفاده مي گردد معادلي براي واحد Todd مي باشد.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
این تست به منظور تشخیص سرولوژیک بیماری آرتریت روماتوئید به کار می رود.در سرم بیماران مبتلا به ارتریت روماتوئید پروتئین های غیر طبیعی متعددی وجود دارد که به علت رابطه نزدیک آنها با بیماری مجموعا به نام فاکتور های روماتوئیدی نامیده می شوند.این پروتئین ها عمدتا متعلق به رده IgM ایمنوگلبولینها می باشند ولی امروزه فاکتورهای روماتوئیدی کلاس IgG ، IgA و همچنین IgE نیز شناخته شده اند.این آنتی بادی ها نوعی انتی گلبولین هستند.زیرا عمدتا در مقابل IgG واکنش می دهند.بنا به این تعبیر می توان آنها را آنتی-آنتی بادی یا اتو آنتی بادی به حساب آورد.
وجود فاکتور های روماتوئیدی در سرم منحصرا به بیماری ارتریت روماتوئید نمی باشد.بلکه در بسیارس از بیماری های عفونی مانند اندوکاردیت باکتریایی حاد،برونشیت،آسم،فیبروزریوی،...وبیماری هایی چون مالتیپل مایلوما،لوپوس،اریتروماتوز،سندروم شوگرن،سارکوئیدوز،سیروز کبدی و .. مشاهده می شود.
آنتی ژن مورد استفاده:
معرف RA Latex - در این آزمون سرم بیمار را با ذرات پلی استیرن لاتکس پوشیده از IgG انسان مجاور می کنند.
در صورت وجود IgM-RF ذرات لاتکس-گلبولین تجمع یافته و آگلوتیناسیون مشاهده می شود
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
مقدمه: جنس بروسلا شامل 6 گونه مي باشد كه از ميان آنها تنها چهار گونه در انسان بيماري زا است؛ بروسلا آبورتوس، بروسلا ملي تنيس، بروسلا سوئيس و بروسلا كانيس. بروسلاها باكتري هاي كوچك غيرمتحرك، گرم منفي، بدون كپسول و به فرم كوكوباسيل مي باشند و اين باكتري انگل داخل سلولي سيستم رتيكولوآندوتليال است و عفونت ناشي از بروسلا انتشار جهاني دارد. هدف: در اين بررسي نتايج تست هاي سرولوژيك بدست آمده از 500 نمونه مشكوك به بيماري مورد بررسي قرار گرفته است. مواد و روشها: روش هاي مختلف آزمايش شامل: رزبنگال، رايت سريع، رايت لوله اي، كومبس رايت، 2ME و IFA مي باشند كه نتايج حاصل از آزمايشات فوق به ترتيب زير مورد مقايسه قرار گرفته اند. نتايج: تيتر آنتي بادي ضدبروسلايي در آزمايش رزبنگال 4/24%، رايت سريع22.2% ، رايت لوله اي 2/21%، كومبس رايت 8/23% و ايمونوفلورسانس غيرمستقيم 4/%21 بود. ميانگين هندسي (GMRT) تيتر آنتي بادي ضدبروسلايي نيز به ترتيب زير بود: رايت لوله اي 5/284، كومبس رايت 4/294 و .۳۲۶.۳ (IFA) توزيع فراواني نسبي تيتر آنتيبادي ضدبروسلايي براساس سن و جنس، مشخص ميكرد كه درصد آلودگي مردان با 3/38% بيشتر از زنان (6/15%) بود و بيشترين موارد مثبت مربوط به گروه هاي سني كمتر از 20 سال و كمترين به گروه هاي سني بيش از 46 سال تعلق داشت. توزيع فراواني نسبي آنتي بادي ضدبروسلايي براساس فصل نيز نشان مي داد كه در فصول مختلف درصد موارد آلودگي داراي اختلاف معنيداري نبود. ويژگي تست IFA بيشتر از آزمايش رايت لوله اي نشان داده شده است (98%) و حساسيت تست IFA بيشتر از آزمايش 2ME مشخص گرديد (100%) نتيجهگيري: به طور كلي، به كارگيري تست IFA در مورد مبتلايان به بروسلوز داراي موارد مثبت كاذب و منفي كاذب كمتري مي باشد.
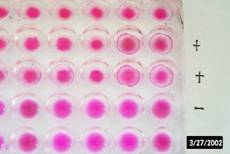
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
از این تست برای شناسایی انتی بادی های ناقص- که بر روی RBC نشسته و انها را حساس کرده است استفاده می شود . این تست به دو روش مستقیم و غیر مستقیم انجام می شود . اساس این تست بر ایجاد شبکه بین آنتی بادی های ناقص در سطح گلبول های قرمز حساس شده (توسط AHG) برای ایجاد آگلوتیناسیون می باشد .این تست در دو مرحله کلی انجام می شود :
1.مرحله حساس شدن
2. اضافه کردن معرف کومبس
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
براي بيمارانيكه به مقادير كم پروتئينهاي پلاسمايي باقيمانده در كيسه گلبول هاي قرمز واكنش نشان مي دهند ، از گلبول هاي قرمز شسته شده استفاده مي شود . اين واكنشها مي توانند به صورت آلرژي زا ايجاد تب يا آنفيلاكسي ظاهر شوند . شستشو باعث از دست رفتن 10% تا 20% از گلبول هاي قرمز مي شود . از آنجا كه مراحل شستشوي گلبول قرمز ورود به كيسه خون را در پي دارد ، لذا سيستم باز به حساب آمده و فرآورده بايد ظرف مدت 24 ساعت مصرف شود .
- مبتلايان به تالاسمي ماژور
- بيماران مبتلا به كمبود IGA (گلبول قرمز شستشه شده اي كه حداقل 5 بار شسته شده باشد )
- هموگلوبينوري حمله اي شبانه
- واكنشهاي ازدياد حساسيتي نسبت به پروتئينهاي پلاسما
- بيماراني كه آلوآنتي بادي دارند
- تزريق خون نوزادان
- تزريق خون داخل رحمي
براي جلوگيري از واكنش تب زاي هموليتيك انتقال خون ، كاهش 90% لوكوسيتها كافي به نظر مي رسد ليكن در برخي از بيماران حتي كاهش 95% براي جلوگيري از واكنش تب زا كافي نبوده و بايد تا 9/99-99% لكوسيتها خارج شوند كه اين ميزان معمولاً با فيلترهاي مخصوص حذف لكوسيت ، امكانپذير مي باشد .
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
توضیح:
برای تعیین گروه های خونی ABO به 2 روش انجام می پذیرد:
1-Cell type
2-Back type
روش Cell type:
این روش به 2 نوع انجام می شود:
*نوع لامی
*نوع لوله ای
روش لامی:
یک لام تمیز برداشته و 2 قطره خون کامل یا گلبول قرمز را روی آن قرار دهید.
1 قطرهAnti A روی 1 قطره خون و1قطرهAnti B روی قطره دیگرخون بریزید.
لام را به مدت 1 تا 2 دقیقه بر روی دستگاه shaker قرار دهید.
لام را از نظر آگلوتیناسیون بررسی کنید.
روش لوله ای:
سوسپانسیون 3 تا 5 درصد خونی تهیه کنید.(روش تهیه سوسپانسیون:5 سی سی خون + 95 سی سی سرم فیزیولوژی)
2 لوله تمیز برداشته ، روی یکی A و روی دیگری B می نویسیم.
از سوسپانسیونی که تهیه کرده ایم یک قطره به لوله A و یک قطره به لوله B اضافه می کنیم.
به لوله, A Anti A و به لوله, B Anti Bاضافه می کنیم.
سپس 2 لوله را برای مدت 1 دقیقه در دور 1000 سانتریفیوژ می کنیم.
لوله ها را از نظر آگلوتیناسیون بررسی می کنیم.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
همانطور كه ميدانيد تستهاي الايزا برپايه اندازهگيري كمپلكس رنگي آنتيژن و آنتيبادي استوار است، گاهي اوقات براي همكاران محترم در اخذ نتايج صحيح، مشكلاتي پيش ميآيد، كه باعث بدست آمدن جوابهاي غير واقعي ميشود، لذا بر آن شديم تا مروري بر منابع خطا در روشهاي الايزا داشته باشيم، اميد است با رعايت موارد ياد شده دقيقترين نتايج در تستهاي الايزا حاصل شوند.
نكاتي كه بايد هنگام نمونهگيري از بيماران و جداسازي سرم مورد توجه قرار گيرند. .
اطلاعات باليني بيمار بطور كامل در يك برگ ثبت شود.
نمونهگيري از بيمار بايد به دقت انجام گيرد زيرا برخي عوامل مثلاً بستن گارو به مدت طولاني ممكن است موجب ايجاد خطا در اندازهگيري تست گردد.
دقت در نحوه جداسازي سرم از لخته به نحوي كه سرم جدا شده حاوي فيبرينوژن و يا ذرات ديگر نباشد.
نمونهمورد استفاده حتيالامكان ليز(Lyses) ،ايكتريك و ليپميك نباشد،
تا حد امكان از فريز و دفريز نمودن نمونههاي موجود جلوگيري شود زيرا باعث كاهش سطح هورمونهاي سرم بويژه FT4 و T4 ميگردد.
نكات قابل توجه قبل از انجام آزمايش .
حمل و نقل کیت ها و همچنين نگهداري آنها بايد در دماي C 8-2 صورت گیرد.
كيت مورد مصرف از لحاظ اعتبار كمپاني سازنده آن، بستهبندي مناسب و نيز موجود بودن تمامي استانداردها و كنترلهاي مثبت و منفي صورت گیرد.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
برای تهیه سرم بدین طریق عمل می شود که پس از عمل خونگیری خون را داخل لوله آزمایش ریخته و چند دقیقه صبر می کنیم تا خون لخته شود سپس با یک لوله همزن شیشه ای بدون شکستگی آن را به هم می زنیم و پس از سانتریفوژ مایع به دست آمده روئی سرم است پس سرم فاقد فیبرینوژن است چون اجازه داده ایم خون لخته شود و فیبرینوژن به فیبرین تبدیل شود وفیبرین در داخل لخته خون باقی مانده و از مایع خون جدا شده است بنا براین به مایع خون که فاقد فیبرینوژن باشد سرم گویند. اما برای تهیه پلاسما پس از خونگیری اجازه لخته شدن را به خون نمی دهیم به وسیله اضافه کردن هپارین و یا سیترات ویا (چلاتور کلسیم)EDTA یا گذاشتن در یخچال آنزیم های انعقادی را غیر فعال می کنیم و پس از سانتریفوژ مایع روئی پلاسما است بنا براین به مایع خون که حاوی فیبرینوژن است پلاسما گویند.
موضوعات مرتبط: ايمونولوژي
سورفاكتانت يك ماده ي عمل كننده در سطح است . به اين معني كه هنگامي كه بر روي سطح يك مايع گسترده مي شود ، كشش سطحي را به مقدار زيادي كاهش مي دهد . سور فاكتانت به وسيله ي سلولهاي اپيتليال ويژه ي ترشح كننده ي سورفاكتانت که حدود 10 درصد سطح حبابچه ها را تشكيل مي دهند ترشح مي شود . اين سلولها گرانول دار بوده و محتوي انكلوزيون هاي ليپيدي هستند و سلولهاي اپيتليال حبابچه اي نوع II ناميده مي شوند. سورفاكتانت مخلوط پيچيده اي ازچندين فسفوليپيد ، پروتئين ها و يون ها است . مهمترين اجزاء آن عبارتند از : فسفوليپيد دي پالميتويل فسفاتيديل كولين ، آپو پروتئين هاي سورفاكتانتي و يون هاي كلسيم ، دي پالميتويل فسفاتيديل كولين همراه با چندين فسفو ليپيد كم اهميت تر مسئول كاهش دادن كشش سطحي است . اين مواد در مايع حبابچه اي حل نمي شوند بلكه بر روي سطح آن گسترده مي شوند ، زيرا يك بخش از هر مولكول فسفو ليپيد هيدروفيليك بوده و در آب مفروش كننده ي حبابچه ها حل مي شود ، در حالي كه بخش ليپيدي مولكول هيدروفوبيك بوده و در جهت رو به هوا قرار مي گيرد و يك سطح هيدرو فوبيك ليپيدي تشكيل مي دهد كه در معرض هوا قرار مي گيرد . اين سطح داراي يك كشش سطحي به ميزان يك دوازدهم تا يك دوّم كشش سطحي آب خالص است . مقدار دقيق كشش سطحي بستگي به غلظت و جهت قرار گرفتن مولكول هاي سورفاكتانت بر روي سطح دارد . اهميت آپوپروتوئين هاي سورفاكتانتي ويون هاي كلسيم اين است كه در غياب آن ها دي پالميتويل فسفاتيديل كولين چنان به آهستگي بر روي سطح مايع گسترش مي يابد كه نمي تواند به طور مؤثرعمل كند.
از نظر مقدار ، كشش سطحي مايعات آب دار تقريبا" به شرح زير است :آب خالص 72 دين بر سانتيمتر، مايعات طبيعي مفروش كننده ي حبابچه ها بدون سورفاكتانت 50 دين بر سانتيمتر و مايعات مفروش كننده ي حبابچه ها با سورفاكتانت بين 5 و30 دين بر سانتيمتر.
عامل کشش سطحی:
اطلاعاتی که در مورد خواص آب وجود دارد اخیرا زمینه بحث در مورد خواص سورفاکتانت(surfactant) ها را فراهم ساخته است.سورفاکتانت به زبان ساده ماده ای است که هنگامی که به مقدار بسیار ناچیز استفاده می شود کشش سطحی آب را به میزان قابل توجهی کاهش می دهد.جدول شماره ۲ نشان می دهد که هنگامی که سافتانول ۹۰ به میزان 0.005 درصد استفاده می شود کشش سطحی آب از ۷۳ به ۳۰ دین بر سانتی متر کاهش می یابد.در حالی که اتانول هنگامی که به میزان ۲۰ درصد استفاده می شود کشش سطحی آب را به ۳۸ دین بر سانتی متر کاهش می دهد.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
دستگاه عصبی خود مختار یا نباتی، به بخشهایی از سیستم عصبی گفته میشود که باعث ثابت ماندن شرایط داخلی بدن میشود و شامل نورونها و الیاف عصبی است. این دستگاه به کنترل فشار خون شریانی، حرکات و ترشح دستگاه گوارش، تخلیه مثانه، تعریق، دمای بدن و بسیاری فعالیتهای دیگر کمک میکند. یکی از خصوصیات دستگاه خود مختار، سرعت و شدت عمل آن در تغییر دادن اعمال احشایی است. به عنوان مثال دستگاه خود مختار طی 3 تا 5 ثانیه قادر است ضربان قلب را به میزان دو برابر افزایش دهد و طی 10 تا 15 ثانیه میتواند فشار خون شریانی را کاهش یا افزایش دهد. این اعمال به صورت غیر ارادی صورت میگیرد، ولی مراکز عالی دستگاه عصبی تا حد زیادی در این اعمال موثرند
دستگاه عصبی خود مختار، عمدتا به وسیله مراکز واقع در نخاع(spinal)،ساقه مغز و هیپوتالاموس(Hypothalamus) فعال میشود. این دستگاه نیز همانند دستگاه عصبی ارتباطی دارای گیرندهها، آورانها، وابرانها و اندامهای اجرا کننده میباشد. اندامهای دستگاه خود مختار شامل عضلات صاف، عضله قلب و غدد است. گیرندههای اندامهای داخلی مانند معده، روده و مثانه، اطلاعات خود را به وسیله تارهای عصبی آوران به مراکز عصبی خود مختار میفرستند و پاسخ انعکاسی این مراکز به وسیله نورونهای رابط و وابران به اندامها ارسال میشود.
بخش وابران دستگاه عصبی خود مختار، به دو بخش جداگانه تحت نامهای بخش سینهای – کمری یا سمپاتیک و بخش جمجمهای – خاجی یا پاراسمپاتیک تقسیم میشود که عمل آنها معمولا خلاف یکدیگر است.
سیستم سمپاتیک Sympatic System
به طور کلی، سیستم سمپاتیک که در حالات اضطراری و هیجان فعالیت بیشتری پیدا میکند نیروهای بدن را بسیج کرده، فرد را برای مقابله با حادثه یا فرار آماده میسازد.
سیستم پاراسمپاتیک Parasympatic System
عمل سیستم پاراسمپاتیک، موضعی و محدود است و باعث برقراری حالت آرامش و حفظ ذخیره انرژی در بدن میشود.
عروق خونی، غدد مولد عرق و عضلات صاف راست کننده موها، عصب پاراسمپاتیک ندارند و تارهای عصبی آنها فقط از نوع سمپاتیک است هر یک از دستگاههای سمپاتیک و پاراسمپاتیک از یک مجموعه دوسلولی که یکی در درون دستگاه اعصاب مرکزی( در ساقه مغز یا نخاع شوکی) و دیگری جسم سلولی(Soma) آن، که گره عصبی(Ganglion) را میسازد تشکیل شده است.
سلول پیش گره عصبی Preganglionic Neuron
سلول عصبی که جسم سلولی آن در دستگاه اعصاب مرکزی قرار داشته و آکسون(Axon) آن به گره عصبی ختم شود، را "سلول پیش گره عصبی" مینامند.
دستگاه اعصاب رودهای Nervous Intestinal
در دستگاه اعصاب خود مختار، علاوه بر سیستم سمپاتیک و پاراسمپاتیک، بخشی نیز به نام اعصاب رودهای وجود دارد که بدون دخالت سیستمهای سمپاتیک و پاراسمپاتیک، کنترل و تنظیم برخی از اندامهای مجری مانند: معده، روده، ماهیچههای صاف، بافت ترشحی، دستگاه عروقی و غدد درونریز را به عهده دارند. بیشتر اجسام سلولی اعصاب رودهای در دو شبکه سلولهای عصبی دیواره روده قرار دارند. یعنی یکی بین ماهیچههای صاف و حلقوی دیواره روده(شبکه عصبی – عضلانی روده) و دیگری زیر ماهیچههای حلقوی(شبکه عصبی زیر پرده مخاطی) قرار دارد.
سلولهای اعصاب رودهای، هم جزء سلولهای حسی به شمار میآیند که در اثر انقباض و انبساط دیواره روده تحریک میشوند، و هم جزء سلولهای حرکتی تلقی میشوند چرا که تارهای ماهیچههای صاف و حلقوی را به حرکت وامیدارند. اعصاب رودهای، همچنین رابط بین سلولهای حرکتی و اعصاب مرکزی نیز میباشد.
بازخورد زیستی یا بیوفیدبک Biofeedback
آگاهی از تغییرات بدنی و فرایندهای زیستی اندامها و بافتها و کوشش ارادی برای مهار کردن و بازگرداندن آنها به حالت مطلوب را "بازخورد زیستی" یا "بیوفیدبک" مینامند.
مراکز عصبی بالای مغز میتوانند تا حدی در اعمال خودکار مراکز سمپاتیک و پاراسمپاتیک اثر گذاشته، آنها را تشدید یا تضعیف کنند. پیامهای ارسالی از بعضی نواحی قشر مخ و دستگاه کناری مغز(سیستم لیمبیک) باعث تغییر در پاسخهای خودکار سمپاتیک و پاراسمپاتیک میگردد و تغییراتی را در فشار خون، ضربان قلب و فعالیت لوله گوارش به وجود میآورد.
موضوعات مرتبط: ايمونولوژي
ادامه مطلب
.: Weblog Themes By Pichak :.

